表观遗传的司机胶质母细胞瘤提供了新的治疗目标
癌症肆意生长的能力通常归因于癌症干细胞,肿瘤细胞的一小部分,无限期生长和繁殖的能力。癌症干细胞如何留住这个属性,而大部分肿瘤的细胞不会在很大程度上仍是个未知数。使用人类的肿瘤样本和小鼠模型,圣地亚哥加州大学的研究人员医学院和穆尔斯癌症中心发现,癌症干细胞属性是由表观遗传changes-chemical修改细胞用来控制哪些基因开启或关闭。
这项研究发表在本周美国国家科学院院刊》上报告说,一种酶被称为Lysine-Specific Demethylase 1 (LSD1)关闭基因需要维持癌症干细胞单元格属性在胶质母细胞瘤,一个高度积极的形式脑癌。这种表观遗传活动有助于解释如何抵抗治疗胶质母细胞瘤。更重要的是,药物,修改LSD1水平可能提供一种新的方法来治疗胶质母细胞瘤。
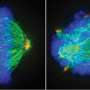
研究人员第一次注意到,基因完全相同的患者分离出的胶质母细胞瘤细胞致瘤性的差异,或者形成肿瘤的能力,当移植到小鼠模型。这个观察表明,表观遗传学,而不是基因(DNA序列),确定致肿瘤性胶质母细胞瘤肿瘤干细胞。
“最引人注目的发现之一在我们的研究中是动态的和可逆的遗传性和非致瘤性状态之间的转换由表观遗传调控胶质母细胞瘤,”陈资深作者Clark说,医学博士,博士,神经外科的副教授和副研究和加州大学圣地亚哥分校医学院的学术发展
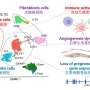
进一步调查,陈的团队发现表观遗传因素决定是否胶质母细胞瘤细胞能无限增殖癌症干细胞是他们LSD1的相对丰度。LSD1去除化学标签被称为DNA甲基,关掉一些维护所需的基因癌症干细胞属性,包括MYC、SOX2 OLIG2 POU3F2。
“这种可塑性是一种机制,通过这种胶质母细胞瘤治疗产生耐药性,”陈说。”例如,这项成果可以逃脱的死亡影响药物的靶向MYC只需epigenetically关掉后,将药物不再存在。最终策略解决这个动态相互作用需要有效的胶质母细胞瘤的治疗。”
陈和该研究的第一作者,杰Li博士指出,驾驶胶质母细胞瘤的表观遗传变化类似于那些发生在正常人类发展。
“尽管大多数细胞在我们的身体包含相同的DNA序列,表观遗传变化使肝细胞不同于大脑细胞,”李说,陈助理项目科学家的实验室。“我们的结果表明,相同的编程流程确定癌细胞可以无限增长。”
更多信息:动态表观遗传调节胶质母细胞瘤致瘤性通过LSD1调制MYC基因表达,www.pnas.org/cgi/doi/10.1073/pnas.1501967112