堵塞细胞高速公路可引发痴呆症和als
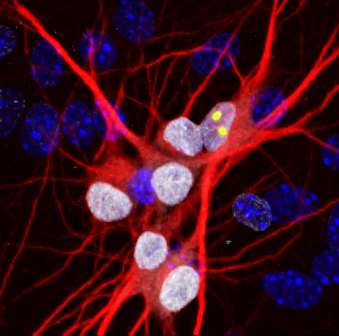
Johns Hopkins研究人员表示,他们已经发现了一个非常常见的基因突变导致脑损伤与肌营养的外侧硬化剂(ALS)和额定仪性痴呆(FTD)相关的脑损伤中的一些阶段。
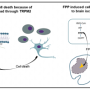
他们报告称,位于人染色体9上的改变的C9ORF72基因导致RNA分子阻断蛋白质转运的关键途径,导致外面的分子交通堵塞脑影响细胞核的运作和存活。在一个概念验证实验中,研究人员还说,分子疗法缓解了堵塞,并恢复了分子进入细胞核心的流动。
关于该工作的报告将于8月26日在线在线公布自然。
"The discovery several years ago of this mutation—the most common one linked to ALS and FTD—was really a game changer for the field because it wasn't a typical genetic mutation," says Jeffrey Rothstein, M.D., Ph.D., a professor of neurology and director of the Brain Science Institute and the Robert Packard Center for ALS Research at the Johns Hopkins University School of Medicine. "Now we have some information about what it is doing early on to damage brain and脊髓细胞。“
该突变,最常见的疾病的遗传危险因素,与40%的遗传性ALS病例相关,其中遗传性FTD的25%和每种疾病的不受限制病例的约10%。这两种疾病的特征是神经退化细胞随着时间的推移。就FTD而言,这种损伤会导致言语、理解语言和处理情绪方面的问题。在肌萎缩性侧索硬化症中,这种退化会影响脊髓细胞和大脑细胞,患者逐渐失去控制肌肉的能力。
根据Rothstein的说法,研究人员知道C9ORF72突变,而不是将一个建筑物DNA结构块改为另一个,导致六个DNA核苷酸延伸以重复数百次。基于突变的DNA,受影响的细胞产生长链的重复RNA,通常负责将DNA在核外转移到核外的遗传密码的遗传物质,以将其转化为蛋白质的机器。
2013年,罗斯坦的实验室在细胞中发现了400多种可能与重复RNA链直接相互作用的蛋白质。现在,该研究小组与约翰·霍普金斯大学的神经学副教授托马斯·劳埃德(Thomas Lloyd)医学博士一起,已经锁定了这些蛋白质中的一种,RanGAP,作为介导突变RNA对细胞影响的关键。
“关键突破来自人类ALS和FTD的果蝇模型,使我们能够为那些阻止这些400名候选人进行筛选脑细胞死亡”劳埃德说。“这项工作将RanGAP确定为C9orf72重复序列的一个关键靶点,当其功能恢复后,可以防止脑细胞死亡。”
在健康的细胞中,RAGAP通过连接细胞的细胞质 - 填充大多数细胞和核 - 含有遗传物质的液体的核孔来通过核孔进行交通分子。
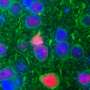
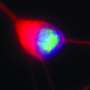
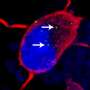
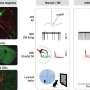
但是,在他们对由Als相关的C9ORF72突变的患者制成的飞行和人脑细胞的实验中,Rothstein和Lloyd发现的植物在细胞核外丛生。此外,依赖于植物的蛋白质用于输送到核的核不会流过核孔隙。
“该组有人体干细胞和飞行模型的数据,但我们真的想知道我们是否可以在患者的大脑中看到这一点,”Rothstein说。“所以我们去了尸体肿块的人脑组织并开始看。”
来自ALS和FTD患者的脑组织切片的检查表现出类似的植物和其他蛋白质 - 包括对神经元功能的一些至关重要的脑细胞核。“现在,苍蝇,人体干细胞和尸检大脑都在这里告诉我们同样的故事,这是一种引起疾病的基本缺陷,”罗斯坦说。
在另一组用苍蝇和人做的实验中干细胞,科学家添加反义寡核苷酸,旨在与重复RNA链结合的RNA的位,阻挡它们与植物蛋白相互作用。卡住了核毛孔重新打开,他们报告,键蛋白再次进入细胞核。
Rothstein推出了与加利福尼亚州的ISIS制药合作,以追求一种药物的开发,可以为ALS和FTD患者做同样的方法。然而,他警告说,必须进行进一步的研究以确认这种潜力,并且商业上可用的药物是多年的休息。
“我们仍然不知道C9ORF72突变与大脑中的细胞死亡之间的每一步,”Rothstein说。“但我们的信念是这就是开始它的原因,这肯定是一个很好的治疗目标。”







用户评论