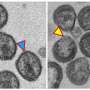
艾滋病毒粒子不会导致艾滋病,我们自己的免疫细胞
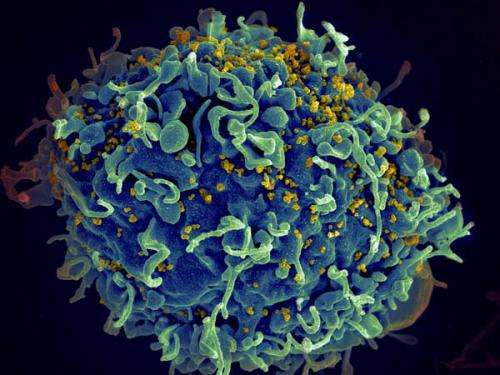
斯顿研究院的研究人员发现,艾滋病病毒不会引起艾滋病的病毒对宿主的免疫细胞的直接影响,而是通过对另一个细胞的致命影响。
艾滋病毒可以通过自由浮动传播病毒直接感染宿主的免疫细胞或病毒感染细胞可以通过一个未受感染的细胞上。第二种方法,细胞细胞传播,更高效的100到1000倍,新的研究表明,只有这个方法,引发细胞连锁反应,在刚结束被感染细胞自杀。
“CD4 T细胞的基本“杀死单位”淋巴组织其他感染的细胞,而不是免费的病毒,“co-first作者Gilad Doitsh博士说,一个员工格拉德斯通病毒学与免疫学研究所的研究人员。”和细胞间传播艾滋病毒艾滋病死亡需要激活的主要途径。”
在一个以前的调查科学家们发现的95%细胞死亡从艾滋病毒所致免疫细胞自杀失败后在自卫感染。当病毒试图入侵细胞感染“静止”,是中止。然而,病毒DNA片段仍然和检测到的宿主细胞。这引发了多米诺效应细胞的防御系统,导致酶的激活caspase-1,最终导致pyroptosis的感应,一种激烈的细胞自杀。
在新的研究中,发表在细胞的报道,据透露,这只死亡通路激活通过细胞间传播艾滋病毒,不是由自由浮动从感染病毒粒子。利用淋巴组织感染艾滋病毒,科学家们相比,细胞死亡率之间的细胞间和细胞游离病毒转移。他们发现感染而整体利率保持不变,有更多的CD4 T细胞死亡如果HIV传播比由自由浮动的病毒感染其他细胞。
“虽然自由浮动病毒建立最初的感染,这是后续细胞间传播艾滋病毒,导致大规模的CD4 T细胞死亡,“co-first作者妮可Galloway说,博士,博士后研究员格拉德斯通病毒学与免疫学研究所的。“细胞间传播HIV病毒的绝对是需要激活的艾滋病毒致病性细胞死亡通路。”
来证实这一发现,研究人员摄动病毒转移通过一系列手段:基因修改病毒,艾滋病毒应用化学抑制剂,阻塞inter-cellular突触,并增加细胞之间的物理距离,所以他们不能接触到另一个。值得注意的是,破坏细胞间接触有效停止CD4 T细胞的死亡。更重要的是,仅在细胞间传播caspase-1激活靶细胞内,从而启动pyroptosis,炎性细胞自杀的反应。
科学家们推测,细胞死亡率的差异在两个方法之间的感染是由于增加细胞间传播的效率。流产的病毒DNA片段快速删除在感染艾滋病毒游离粒子,所以他们没有检测到细胞的防御系统。然而,在细胞间传播,病毒DNA片段压倒电池维护、建设直到他们超过一个阈值和检测。这触发caspase-1激活和pyroptosis。
“这项研究从根本上改变我们的心态如何艾滋病导致大量细胞死亡,并将焦点落在受感染的细胞在淋巴组织,而不是免费的病毒,“资深作者华纳c·格林说,医学博士,博士,格莱斯顿病毒学与免疫学研究所的主任。“通过阻止细胞-细胞传输,我们也许能够阻止的死亡通路和停止发展HIV感染艾滋病。”