矫正蛋白质结构揭示了癌症的药物靶标,神经变性疾病

蛋白激酶C(PKC)是通过附着化学标签来控制细胞中其他蛋白质的活性的酶系列。简单的行为有助于确定细胞生存或死亡。当它出错时,可能会导致一些疾病。在8月13日出版的一项研究中细胞的报道美国加州大学圣地亚哥分校医学院的研究人员揭示了PKC更精确的结构,为根据需要微调该酶的活性提供了新的目标,以改善人类健康。
药理学教授亚历山德拉·c·牛顿博士说:“通过了解PKC是如何夹住自己闭合的,我们现在可以寻找方法把它楔开,以保持它的活性。”“这对于开发癌症疗法有很大的潜力,因为保持酶的‘开启’位置将促进肿瘤细胞的死亡。”我们也想在神经退行性疾病上做相反的事情,我们需要治疗来保持神经元的活力。”
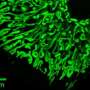
研究人员通常使用称为X射线晶体学的技术来确定蛋白质的3D结构。但有时他们必须做出假设,以便尽可能地拟合数据。在2011年的一项研究中,一个不同的研究小组解决了PKC的大部分结构,并尽最大努力猜测所有作品如何合适。
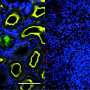
但这种结构与PKC的生物学原理不符。在与加州大学圣地亚哥分校医学院药理学教授苏珊·泰勒博士的研究团队的合作下,牛顿和研究人员对如何连接酶的各个部分或结构域进行了另一种研究。他们提出了一种不同的结构,并使用一种复杂的细胞成像技术来测试PKC是否被正确地打包在一起。
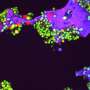
研究人员发现PKC的钙感应(C2)结构域与它自己的尾巴和酶的结构域(进行化学标记的部分,一个称为磷酸化的过程)相互作用,将酶锁定在一个不活跃的姿势。当钙触发C2结构域与细胞膜的桥接时,PKC开始激活,从而打开酶的活性。
该团队还通过突变将结构域连接在一起的蛋白质的特定部分,在未打包和正确打包的结构之间解锁和重新锁定PKC来验证这种打包。
“了解持有PKC关闭的接口现在将允许设计小分子,可以破坏PKC域之间的相互作用以打开并激活酶或者将域夹住以防止其激活,“博士学位,博士学位,博士学位,博士学位,他是牛顿实验室的研究生。
进一步探索








用户评论