2015年9月10日报告
近距离观察蛋白质参与帕金森病显示段参与淀粉样蛋白的形成
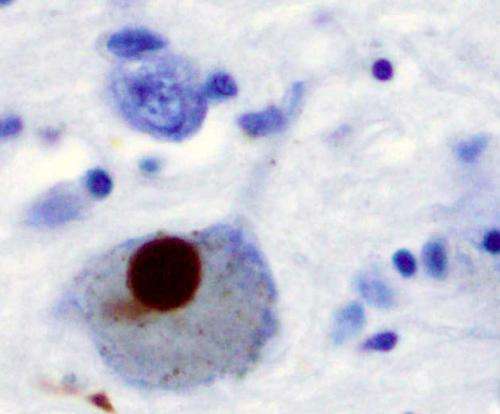
(欧宝娱乐地址医学Xpress)——一组科学家从几个研究中心在美国已经仔细看看α-synuclein,富含的蛋白质在人类的大脑,和也参与了帕金森病的发展。在他们的论文发表在杂志上自然,研究小组描述了他们的研究,提供一些新的想法神经退行性疾病可能是由于纤维的形成。英国剑桥大学的米歇尔Goedert和程一帆霍华德休斯医学研究所提供新闻和观点一块团队所做的功以及它如何增加了更清楚的了解帕金森氏症等疾病的开始。
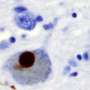
α-synuclein是蛋白质最常提示的神经细胞和被认为是参与神经元之间的通信通过脂质绑定。然而,在某些情况下,α-synuclein执行异常和原因原纤维形成了这种纤维倾向于迁移导致脑组织损伤和相关neurodegeneration-this在帕金森病发生了什么,这仍然是无法治愈的。在这个新的研究中,研究人员仔细看看一段的氨基酸构成的一部分α-synuclein-peptides对应残留68 - 78。指出晶体形成的核心都太小,视图与光学显微镜(因为它们比光的波长小)团队而不是使用微电子衍射。这样做不仅允许他们看到缩氨酸,但对面对面β-sheets被认为是原纤维的构建块。
大多数以前的研究已经涉及残留位于30至53罪魁祸首参与帕金森病的发展,但现在,根据这项新研究的结果,看来68年和78年之间残留可能扮演一个角色。研究人员认为,这一地区可能与比较研究的地区导致增强的原纤维形成的方式发生。
Goedert和程指出,新发现的结构信息可以帮助发展的分子能够抑制α-synuclein纤维的形成,从而作为一种手段,阻止这种退化性疾病的进展。
进一步探索
文摘
蛋白质α-synuclein路易小体的主要组成部分,neuron-associated总量在帕金森病和其他神经退行性疾病。NACore 11-residue段,我们词,似乎是负责人类α-synuclein淀粉样蛋白的形成和细胞毒性。在这里,我们描述晶体的NACore尺寸小于可见光的波长,因此通过光学显微镜是看不见的。的晶体太小数千倍结构同步x射线衍射测定,我们使用微电子衍射确定结构在原子分辨率。1.4解决结构表明,这个方法可以确定未知的蛋白质结构和收益,据我们所知,最高分辨率通过任何低温电子显微镜方法。展品原纤丝结构对面对面β-sheets造的。x射线纤维衍射模式的相似性NACore长篇α-synuclein有毒的纤维。NACore结构,结合第二部分,激发一个模型对于大多数的命令部分有毒,全身α-synuclein须根,展示的机会α-synuclein纤维的抑制剂的设计。
©2015医疗欧宝娱乐地址Xpress