基因编辑研究揭示镰状细胞病可能的“致命弱点”
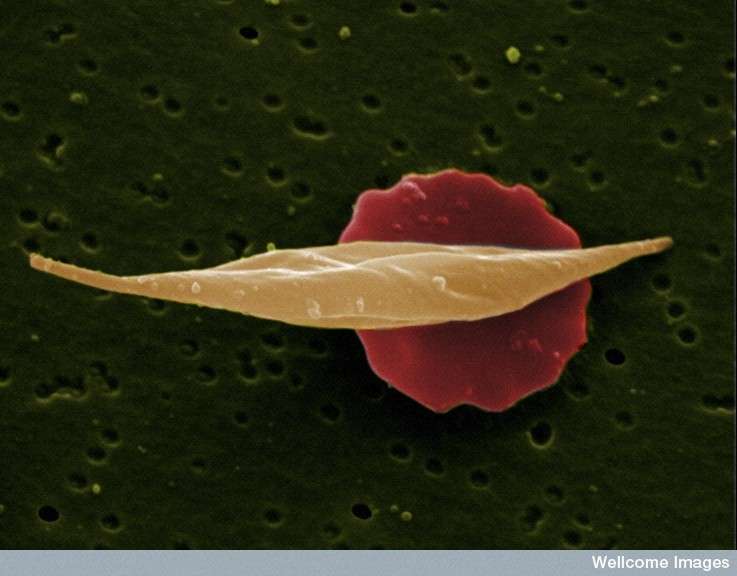
来自达纳-法伯/波士顿儿童癌症和血液疾病中心的研究人员发现,改变一小段DNA可能会规避镰状细胞病(SCD)背后的遗传缺陷。这一发现发表在该杂志上自然这为开发基因编辑方法来治疗SCD和其他血红蛋白疾病(如地中海贫血)开辟了一条道路。
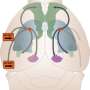
这段DNA被称为增强子,控制着分子开关BCL11A。这个开关反过来又决定了a是否红细胞产生成人形式的血红蛋白(SCD中突变的血红蛋白)或胎儿形式的血红蛋白(不受镰状突变的影响并抵消其影响)。其他研究表明,胎儿血红蛋白水平升高的镰状细胞病患者病情较轻。
新自然这项研究是由Dana-Farber/Boston儿童医院的Stuart Orkin医学博士和Daniel Bauer医学博士以及麻省理工学院和哈佛大学Broad研究所的Feng Zhang博士领导的,他们发现这种增强子DNA序列中自然发生的有益变异只在红细胞中降低BCL11A。
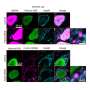
为了模拟和改善这些变异的效果,研究团队使用了最近开发的基于crispr的基因编辑工具,沿着人类捐献者血液干细胞中增强子的整个长度,系统地逐步切割出微小的DNA片段。然后,他们让这些细胞成熟为红细胞,发现细胞产生的胎儿血红蛋白数量大幅增加。该团队的实验揭示了增强剂中的一个特定位置,当切割时,会产生高水平的胎儿血红蛋白.在动物模型中进行的平行实验显示,去除这部分增强子只会影响BCL11A在红细胞中的表达,而不会影响BCL11A同样活跃的免疫细胞或脑细胞。这些发现表明,这种影响仅限于红细胞,而其他类型的细胞不受影响。
“到目前为止,还没有有效的方法来进行这种实验,”鲍尔说,他是达纳法伯/波士顿儿童医院的儿科血液学家/肿瘤学家。“我们的目标是打破增强子,而不是修复血红蛋白突变,但要以非常精确的方式做到这一点,这是唯一可能的基因编辑像CRISPR这样的技术变得可行。”
自从Orkin的实验室揭示了BCL11A开关在从胎儿到成人血红蛋白转变中的直接作用后,人们对探索BCL11A开关潜在临床用途的兴趣越来越大自然在2009年。另一个重要的进展发生在2013年,当时《科学》杂志发表了他们的报告,发现了只在红细胞中指导BCL11A表达的增强子。
“我们现在已经瞄准了致病基因修饰剂的修饰剂,”丹娜-法伯/波士顿儿童医院的领导者、丹娜-法伯癌症研究所儿童肿瘤学主席、波士顿儿童医院血液学/肿瘤学副主任奥尔金解释说。“这是一种非常不同的治疗疾病的方法。”
这些数据证明,在血液干细胞中靶向编辑BCL11A的增强子可能是治疗SCD和相关疾病的一种有吸引力的方法。
“这些实验可能揭示了基因的致命弱点镰状细胞病奥金说。“改变增强子的这些特定部分与将整个增强子完全敲除具有相同的效果,这表明这可能是一种有前途的策略,可以应用于临床。”
“虽然修复镰状突变本身似乎是最直接的方法,但事实证明,血液干细胞鲍尔补充说:“这种治疗的最终目标是基因修复,而不是基因破坏。”“因此,做一个单一的DNA切割,只破坏增强子血液干细胞这可能是一个更可行的策略。”
进一步探索







用户评论