分子“反馈回路”可以解释三苯氧胺耐药性乳腺癌患者
由于未知的原因,许多乳腺癌患者治疗与抗雌激素药物它莫西芬receptor-blocking最终成为治疗尽管他们的肿瘤细胞仍有雌激素受体蛋白质药物通常目标。现在,约翰霍普金斯Kimmel癌症中心的科学家和他们的同事追踪了一个错综复杂的分子途径在这些细胞他们说可以解释,至少部分,三苯氧胺耐药性如何发展。
研究结果,利用人工培养人乳腺癌细胞,总结了在线在《华尔街日报》7月15日癌症的发现。如果进一步的研究确认和扩展了研究结果,研究人员说,他们的发现可能导致新的治疗方法,预防耐药患者引发的乳房肿瘤是自然产生激素,雌激素。
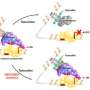
所谓的人雌激素受体(ER)阳性乳腺癌,它莫西芬阻止肿瘤细胞的受体结合雌激素,从而激活其他促进癌细胞的分子。在新的研究中,Kimmel癌症中心研究员萨拉斯瓦提Sukumar,博士和她的同事发现,蛋白质HOXB7参与细胞的“反馈回路”活动,帮助雌激素受体躲避它莫西芬的影响。
具体地说,研究小组分析了15人乳腺癌细胞系,发现HOXB7和雌激素受体之间的伙伴关系有助于产生更多的蛋白质称为MYC在这些细胞。Sukumar说,太多MYC在癌症细胞,可以抑制小分子的行为称为微196,通常会刹住HOXB7的生产。
总的来说,科学家们表明,HOXB7蛋白质associates tamoxifen-resistant的雌激素受体细胞,帮助激活ER-targeted基因,包括HER2。乳腺癌HER2蛋白往往更具侵略性和快速增长的癌症,虽然这些癌症的治疗药物赫赛汀(曲妥珠单抗)改善妇女的生存与近年来早期乳腺癌30%。他莫昔芬耐药细胞中HER2蛋白稳定MYC,允许它继续在更长时间的癌症相关的功能。
分子的反馈回路连接MYC HOXB7, ER和HER2治疗tamoxifen-resistant癌症可能提供了许多不同的目标,说Sukumar,但发展方式干扰MYC战略可能是最有用的。
”针对MYC在HOXB7似乎是一个潜在的强大方式,因为HOXB7控制这么多的途径,你可以大量的崩溃通路参与乳腺癌一举,“Sukumar解释道,肿瘤学和病理学教授约翰·霍普金斯大学医学院的。
该研究小组测试这个想法通过消耗tamoxifen-resistant MYC水平细胞使用化学MYC基因“沉默”。沉默使细胞再次回应它莫西芬,Sukumar说。Sukumar和他的同事们还测试了两个实验的小分子抑制剂MYC在乳腺癌细胞系,发现抑制剂减少HOXB7和HER2的水平。研究人员也能够显著缩小肿瘤在小鼠体内植入使用抑制剂和赫赛汀的组合。
服用他莫昔芬的女性因为“大量的最终产生耐药性,这些结果表明,它可能是更好的开始从一开始就使用MYC抑制剂,以防止三苯氧胺耐药性的发生,”Sukumar建议。“通过这样做,有可能我们可以消除所有的癌症细胞和显著减少复发的机会,由于三苯氧胺耐药性。”
Sukumar说,目前,没有使用任何MYC-targeting临床试验药物或药物组合干扰分子的反馈回路。
Sukumar说MYC-HOXB7-HER2途径也可能是有用的在预测患者预后乳腺癌谁与他莫昔芬治疗。当她和她的团队检查测试结果在1208年水平的HOXB7这类患者在癌症数据库开发的乳腺癌的分子分类学国际财团,他们发现患者高水平的HOXB7蛋白质是1.3倍,可怜的整体存活率比那些较低的蛋白质水平。高水平的患者HOXB7, MYC和HER2的联系更加强烈:患者大量的三种蛋白质都是2.8倍差总体存活率相比非常少。
进一步探索