研究发现阿尔茨海默氏症相关的蛋白质缠结是如何在大脑中传播的
马萨诸塞州总医院(MGH)的研究人员发现了神经纤维缠结(阿尔茨海默病的两个特征之一)通过受影响个体的大脑传播背后的机制。在该杂志在线发布的一份报告中自然通讯研究团队描述了他们发现的一种特定版本的tau蛋白,尽管即使在阿尔茨海默病患者的大脑中也是极其罕见的,但它能够从一个神经元传播到另一个神经元,以及这一过程是如何发生的。
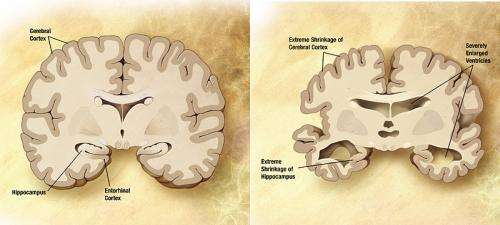
“据推测,缠结是tau蛋白的异常积累神经元在阿尔茨海默病中-可以随着疾病的发展从一个神经元传播到另一个神经元,随着疾病的发展在大脑中传播功能障碍。但这是如何发生的还不确定,”MGH阿尔茨海默病研究中心主任、该报告的资深作者、医学博士布拉德利·海曼说。“我们目前的研究表明,其中一种机制是,一种独特而罕见的tau蛋白具有我们正在寻找的特性——它从神经元中释放出来,被其他神经元吸收,在轴突上下运输,然后再次释放。”
之前的研究表明τ缠结首先出现在大脑深处的一个叫做内嗅皮层的结构中,它是海马体和大脑皮层之间传递信号的枢纽。缠结在邻近的其他与记忆和认知有关的结构中出现得较晚,但这种进展是否反映了大脑的运动τ蛋白通过邻近的神经元或其他过程是不确定的。海曼团队和其他人2013年的几项研究显示,在小鼠模型中,一种突变形式的tau蛋白在大脑结构之间移动,并导致神经退行性变。海曼的一篇论文还提出,这一过程可以停止,但细胞间的运输究竟是如何发生的还需要证明。
目前的研究表明,当来自该小鼠模型的大脑样本应用于培养的神经元时,这些样本中只有1%的tau蛋白被神经元吸收。被吸收的tau蛋白是高分子量的——这意味着许多较小的蛋白质结合在一起形成了一个较大的分子——可溶性的,并且点缀着大量的磷酸盐分子,这是已知的tau蛋白在阿尔茨海默氏症相关缠结中的特征。在使用阿尔茨海默氏症患者的大脑样本进行的实验中,无论是培养的神经元还是活体小鼠,都看到了类似的结果。使用MGH BioMEMS资源中心开发的微流体设备演示了这种tau蛋白在神经元之间传递的过程。
该装置由三个腔室组成,前两个腔室包含老鼠神经元,通过微槽连接,轴突(将信号从一个神经元传递到另一个神经元的纤维)可以延伸。研究小组发现,应用这种罕见形式的tau蛋白从大脑小鼠模型在第一个腔室的神经元中,蛋白质被这些神经元所吸收,并在五天内出现在第一腔室神经元轴突的末端和第二腔室的神经元中。几天后,在从第二室延伸到第三室的轴突末端检测到tau蛋白,其中不含神经元。
从第一个腔室移除tau并没有导致它从第二个腔室消失,这表明一旦一定量的病理版本的蛋白质被吸收,即使在原始来源被移除后,神经元也可以继续传递它。对来自阿尔茨海默病患者大脑的tau蛋白进行的额外实验证实,高分子量、可溶性、含磷酸盐的tau蛋白被吸收并在神经元之间传递。
“我们的研究结果表明,这种形式的释放和吸收τ是疾病从一个大脑区域传播到另一个大脑区域的重要一步,”哈佛医学院神经学约翰·彭尼教授海曼说。“由于这种传播可能是症状临床进展的基础,针对传播机制可能有希望稳定疾病。”














用户评论