分子清除机制使突触能够持续释放递质
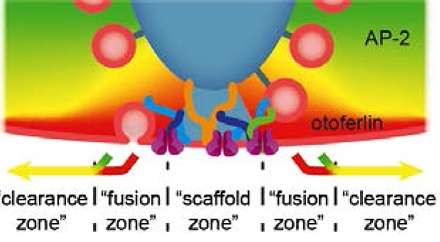
听觉神经科学家发现了耳内信息流的瓶颈,为耳聋基因治疗铺平了道路。发表在EMBO杂志.
全球有3.6亿人患有致残性听力障碍(HI),而且发病率随着年龄的增长而增加。到目前为止,对于其最常见的形式——感音神经性HI,还没有有效的治疗方法。Göttingen和柏林的科学家们已经在我们对听力的理解上取得了重大进展,并且在发展听力方面迈出了重要的一步基因治疗耳聋的。他们的研究表明,内吞适配器蛋白2μ是听力所必需的,通过为释放位点的囊泡重新加载而不疲劳突触传递.如果没有AP-2(它与耳聋蛋白otoferlin相互作用),释放位点就会发生一种交通堵塞,这表明AP-2和otoferlin在清除释放位点的胞外物质方面有协同作用。利用病毒介导的完整AP-2μ DNA转移到感觉内层毛细胞科学家可以恢复正常的突触功能和听力。
这项研究是由几个研究机构的科学家在Göttingen校园889合作研究中心(CRC)进行的。“感觉处理的细胞机制”和柏林莱布尼茨分子药理学研究所的科学家。这项工作发表在EMBO杂志。
感觉毛细胞和听觉神经细胞之间的特殊接触点,即所谓的“带状”突触,将听觉信息转换为内耳中的神经代码。突触传递的速率达到惊人的每秒数百个,这就要求突触囊泡在递质释放的活跃区域进行高效而不知疲倦的招募、融合和再循环。这一非凡的表现包括感音神经性耳聋缺陷的耳托佛林。然而,Otoferlin与突触其他蛋白质的潜在相互作用尚不清楚。
释放位点的超快补充需要融合后的高效清除
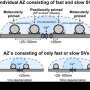
是什么限制了毛细胞突触的传输速率?Otoferlin是如何实现永不疲劳的发射器释放的?每个亚微米大小的活动区可能每秒释放大约1000个充满递质的突触囊泡。如此高的流量导致大量的囊泡蛋白和脂质滞留在活性区的膜上。突触似乎利用专门的机制将这些滞留物质从融合区清除到清除区,然后通过内吞作用(再摄取到细胞内)将其回收。高效的“主动区间隙”对于释放位点的超快重装药可能很重要。到目前为止,这是如何运作的尚不清楚。
利用柏林和Göttingen产生的转基因小鼠系,科学家们现在发现,内吞机制的关键组成部分适配器蛋白AP-2μ在活性区清除中起着重要作用。当小鼠的毛细胞缺乏AP-2μ时,它们就会失聪。耳聋的结果是缓慢的囊泡在释放部位的活动区域,如多学科的方法证明。卡罗林·维奇曼博士是大学医学中心听觉神经科学研究所(Göttingen)的小组负责人,也是该研究的第一作者之一,他说:“我们很惊讶,在刺激的万分之一秒时,传递器的释放速度已经减慢了。此前,AP-2被报道主要在较慢的囊泡循环过程中起作用。”为了了解其潜在的分子机制,科学家们还研究了AP-2的相互作用,发现AP-2与Otoferlin(一种人耳聋缺陷分子)结合,也支持活性区的囊泡补充。
柏林莱布尼茨分子药理学研究所的小组负责人、第一作者Tanja Maritzen博士说:“我们发现AP-2和Otoferlin至少通过两个结合位点相互作用。此外,我们的实验表明AP-2μ对于维持Otoferlin的正常水平至关重要。”
但AP-2与Otoferlin的相互作用是如何加速活性区的囊泡补充的呢?Andreas Neef博士,组长在Göttingen Bernstein计算神经科学中心和MPI动力学和自组织中心,一位通讯作者指出:“基于在单个活动区域(这些突触的独特机会)释放发射机的系统生理记录与数学建模相结合,我们假设AP-2通过与Otoferlin结合来加速活动区域的清除。”因此,科学家们相信,胞吐物质可以被更快地清除,从而使新的囊泡进入,并为下一轮的递质释放做准备。缺乏AP-2或Otoferlin会导致“交通堵塞”并损害声音编码:导致耳聋。
这项研究是世界上第一个证明在动物模型中使用非致病性病毒进行基因替代治疗的可行性的研究之一。大学医学中心听觉神经科学研究所(Göttingen)的科学家、第一作者之一SangYong Jung博士说:“当将携带AP-2μ DNA的腺相关病毒注射到这些失聪小鼠的耳蜗中时,我们可以恢复毛细胞突触和听力的功能。”
该研究的领导者Volker Haucke博士(leibniz -分子药理学研究所所长和柏林自由大学教授)和Tobias Moser博士(大学医学中心听觉神经科学研究所所长Göttingen和生物物理化学和实验医学MPIs的Max-Planck-Fellow)一致认为,这项研究为我们理解AP-2在突触传递中的功能提供了重要的进展,同时,为未来耳聋的基因治疗铺平了道路。
Haucke:“听觉系统的高通量性能使我们能够更好地了解AP-2在活动区的功能。AP-2和Otoferlin似乎在“主动区域清除”方面进行了合作,以实现听力所需的惊人传输速率。Moser补充说:“虽然到目前为止我们还不知道AP-2突变引起的人类耳聋,但我们的研究带来了希望,即病毒介导的基因疗法可以在不久的将来应用于临床。基因治疗后,一只耳朵的听力接近正常,并且病毒没有传播(例如到另一只耳朵),这表明早期干预可以恢复选择性遗传性耳聋的听力。”
进一步探索










用户评论