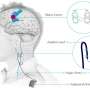
与ALS和FTD相关的核运输问题
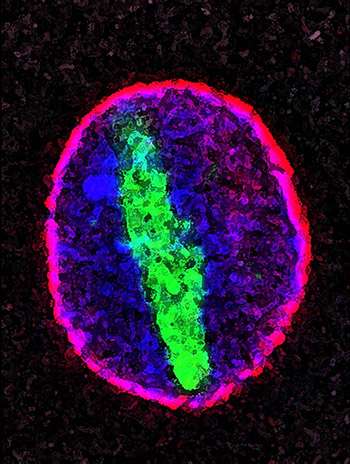
国家健康研究院支持的三个科学家们表明,与某些形式的肌萎缩侧面硬化(ALS)和额定颞造昔路(FTD)相关的遗传突变可以通过破坏细胞核中材料的运动来破坏神经元,或者将大多数DNA存储的指挥中心。结果,在期刊上发表自然和自然神经科学,为治疗这两种疾病提供一种可能的策略。
“这项研究引发了焦点的作用核运输健康地神经元美国国立卫生研究院神经疾病和中风研究所(NINDS)的项目主任Amelie Gubitz博士说。“研究结果对这种突变如何破坏神经元的一个重要过程提供了新的见解,并为治疗的发展开辟了新的途径。”
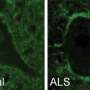
ALS和FTD都是由特定神经元的死亡引起的。在肌萎缩性侧索硬化症中,这导致运动困难并最终瘫痪,而在FTD中,患者在语言和决策方面存在问题。过去的研究将C9orf72基因的一种特定突变与40%的遗传性肌萎缩性侧索硬化症病例、25%的遗传性FTD病例以及每种疾病近10%的非遗传性病例联系起来。最近在酵母、果蝇和病人的神经元上进行的实验发现,这种突变会阻止蛋白质和称为RNA的遗传物质在细胞核和周围的细胞质之间移动。
“在一天结束的时候,这个高潮缺陷遗传信息的流动,从而导致问题表达基因在正确的时间在正确的地方,”保罗·泰勒说,医学博士,博士,研究员圣裘德儿童研究医院在孟菲斯,田纳西州,资深作者的论文之一。
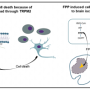
DNA是由核苷酸构成的。在突变的C9orf72基因中,一个由6个核苷酸组成的序列的重复次数比典型的多很多倍。这些DNA的重复延伸产生RNA分子,可以干扰细胞中的蛋白质。这种RNA还会产生一种叫做双肽重复蛋白的有毒蛋白质。然而,直到现在,人们还不知道这两种突变的产物会损害哪些特定的细胞系统。
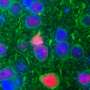
这三组科学家都发现了基因突变会损害患者皮肤细胞中神经元的核运输的证据。泰勒博士的团队发现,这些神经元的细胞核中有更多的RNA,比从健康的控制细胞中产生的神经元要多,这意味着突变阻止了RNA离开细胞核。另外两个小组发现,病人产生的神经元也难以将某些蛋白质带入细胞核。
由Jeffrey Rothstein,M.D.,博士领导的研究人员来自巴尔的摩的约翰霍普金斯大学,重点是C9ORF72突变产生的异常RNA如何影响称为rangap的蛋白质,这对于将材料传送到细胞核中是必不可少的。基于以前的工作,该组证实RNA链与突变患者的脑组织中的rangap结合,并阻止蛋白质进行其功能。然后,该团队将这些细胞与预防这种干扰的化合物进行处理,并发现这消除了传输缺陷,使蛋白质进入细胞核。同样,果实中的植物在果实中的产生降低了突变引起的神经元劣化和运动问题。
罗斯坦博士说:“这项研究定义了ALS和FTD如何开始的临界点,即核细胞质运输的中断。”“通过检查苍蝇模型、活的人类脑细胞和来自尸体解剖的真实人体组织的组合,这些研究全面地告诉我们是什么引发了这种疾病。”
除了与实验室生长的神经元合作之外,泰勒博士除了将八个,28,或58份重复的DNA序列插入果蝇神经元,博士博士还探讨了突变的效果。他们发现额外的副本对细胞造成更多伤害。然后,该组进行了遗传性“筛选”,其中它们系统地突变了其他飞基因以找到增加或减少这种损伤的灭菌基因。他们找到了许多基因,他们发现核转运蛋白的代码,其调节分子的运动进出细胞核。
泰勒博士说:“我们非常惊讶地发现了18个与核质运输有关的基因,所以我们知道我们的研究取得了巨大的成功。”
与此同时,由斯坦福大学的亚伦吉勒,博士学位领导的第三部研究人员在含有C9ORF72突变产生的含有有毒二肽重复蛋白质的酵母细胞中进行了类似的屏幕。与泰勒博士的研究一样,这些实验表明,核运输的基因会影响多肽重复蛋白对细胞有何有害。
吉特勒博士说:“令人鼓舞的是,使用独立方法的多个研究小组都集中在相同的基因和途径上。”
综上所述,这三项研究表明,旨在增加核质转运的疗法可能对某些形式的ALS和FTD有效。
进一步探索
Brian D. Freibaum等人。GGGGCC在C9ORF72中重复扩展妥协核细胞质运输,自然(2015)。DOI: 10.1038 / nature14974
Ana Jovičić等人。C9orf72双肽重复毒性修饰剂将核质运输缺陷与FTD/ALS连接起来,自然神经科学(2015)。DOI: 10.1038 / nn.4085








用户评论