治疗恢复脊髓性肌肉萎缩症的一些功能在动物模型
工作涉及多个小鼠模型发展的新一代,杰克逊实验室(JAX)研究人员测试了治疗脊髓性肌萎缩(SMA),恢复一些功能失去了由于有一个基因突变(SMN1)和放大保护性基因(SMN2)的水平。
此外,与目前的干预,治疗后似乎工作SMA已经出现的症状,并可能不需要直接管理到中枢神经系统。
SMA是一种神经退行性疾病引起的突变导致的损失函数的运动神经元存活(SMN)基因。SMN1,顾名思义,是至关重要的,适当的运动神经元功能和维护。SMA患者不同程度的严重性因为同族体基因的存在,SMN2,人类。SMN2提供了一些保护,因为少量的蛋白质产生它像SMN1函数。因此,SMA疾病预后取决于有多少份SMN2礼物。两个或更少的副本SMN2导致发病早,更严重的疾病,而三个或更多副本提供足够的功能,导致后来发作,SMA的温和的形式。
SMA小鼠模型已被证明是困难。当前的小鼠模型表达少量SMN蛋白早期死亡,约两周的年龄。然而,这种蛋白质水平增加少量呈现几乎正常的老鼠。这使得治疗测试非常困难,不模型相关的症状或流程不太严重的疾病的类型。
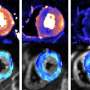
猫Lutz领导的研究小组,博士,主任JAX罕见和Orpan疾病中心,正在努力提高SMA在小鼠模型的能力。10月12日发表的美国国家科学院院刊》上,他们的第一步是基因工程小鼠模型与人类SMN2增加副本数量。通过这个工作他们能够开发一个非常温和的神经肌肉缺陷的小鼠模型,生命接近正常的寿命,和小运动神经元去神经。所以仍然需要一个更好的模型。
与SMN1研究人员开发了一个模型,人类SMN2和第三个等位基因(被称为C等位基因),结合人类SMN2的部分鼠标SMN的部分。这种组合产生鼠标有一个相对较长的寿命严重突变体(大约100天)结合SMA-like神经肌肉疾病表型。
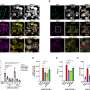
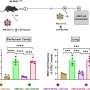
新模型,称为“Burgheron”荣誉的研究人员提供了集成的等位基因,让鲁茨和她的同事测试电流治疗干预,恢复SMN级别和严重的模型中有一个显著的影响。治疗,被称为一个反义寡核苷酸,努力恢复Burgheron SMN水平模型太,甚至注射后25天症状就开始增加寿命和恢复肌肉的运动单位功能。
“大多数的临床前数据,我们必须日期来自I型动物模型,表明早期干预治疗SMA是必要的,”鲁茨说。“然而,我们真的没有良好的临床前数据支持是否也如此II / III型患者,大多数病人生活在SMA代表。我们的数据表明,post-symptomatic治疗,到小鼠的疾病状态,临床相关的治疗效益。”
人体试验的治疗包括反义寡核苷酸直接传递到中枢神经系统(CNS)。外围应用小鼠模型有好处,即使是在神经肌肉接点提高的问题可能会替代人类交付机制。
“好处可能不会被限制在中枢神经系统交付,”卢茨说,“这开辟了一个全新的潜在类化合物和联合疗法的可能性。在人类还需要进一步研究,但non-CNS交付的前景是重要的潜在好处的病人。”
更多信息:劳伦·Bogdanik et al .系统性postsymptomatic反义寡核苷酸救援运动单位成熟延迟一个新的小鼠模型II / III型脊髓性肌萎缩,美国国家科学院院刊》上(2015)。DOI: 10.1073 / pnas.1509758112