发现癌症干细胞胚胎开关的发现
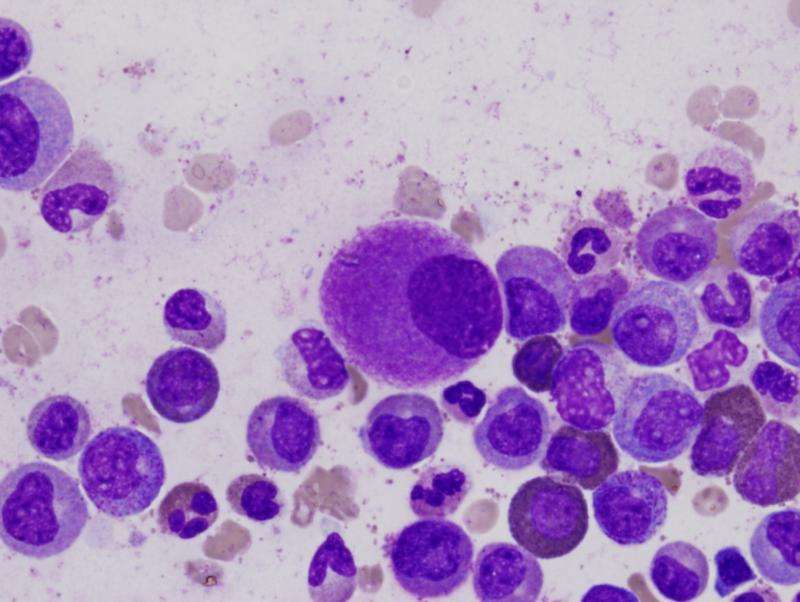
由UC San Diego Moores癌症中心UC San Diego Moores Cancer Center的研究人员领导的国际科学家队,报告称,特定的蛋白质群体触发癌细胞的变化,可加速治疗抗癌癌症的生长和发育细胞(CSCs)。
该发现表明潜在的新治疗方法来消除血液癌的潜力,影响超过110万美国人。事实上,研究人员发现,在细胞和小鼠模型中,使用靶向单克隆抗体的治疗方法有效地损害了CSCS对再生的能力,并使它们更容易地用现有的酶靶向(酪氨酸激酶抑制剂)疗法来消除。
研究结果发表在11月30日的《科学》杂志网络版上美国国家科学院院刊。
这是第一个描述癌症干细胞通过降低胚胎选择性剪接模式的转录抑制因子的表达来增强干细胞自我更新和存活,”资深作者Catriona Jamieson说,他是医学博士,副教授,医学博士,他是莫尔斯癌症中心再生医学部主任和干细胞研究主任。
“而不是获得多个DNA突变,如之前认为的,癌症干细胞在慢性骨髓白血病(CML)切换到胚胎RNA剪接,这提高了它们的自我续订或克隆自己的能力,“Jamieson说。”如果我们可以检测到胚胎剪接,我们可能能够防止癌症干细胞传播自己。此外,如果我们靶向癌症的蛋白质的胚胎版本,如CD44变体3,具有特异性抗体酪氨酸激酶抑制剂,我们可能能够规避癌症复发 - 癌症相关死亡率的主要原因。“
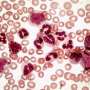
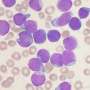
Jamieson及其同事发现,肌盲样3 (MBNL3) RNA结合蛋白的下调导致了人类胚胎干细胞特异性选择性剪接基因调控网络的重新表达——这是一种控制胚胎干细胞多能性和命运的机制。一种效应是在细胞危象CML中,将祖细胞重编程为CSCs。爆炸危机发生时,有20%或更多白血病干细胞在血液或骨髓中。它是白血病最先进的阶段。
然而,研究人员发现,用人源化的pan-CD44单克隆抗体和一种靶向酪氨酸激酶拮抗剂进行治疗,会破坏CSCs在其受保护的微环境中的发育,迫使它们进入血液,而酪氨酸激酶抑制剂达沙替尼可以有效地靶向它们。
进一步探索










用户评论