First-in-class试验性治疗显示了淋巴瘤患者早期的承诺
Pevonedistat first-in-class,临床实验NEDD8-activating酶的小分子抑制剂,国王解释道。”这种酶是ubiquitin-proteasome系统的一部分,它的目标是fda批准的抗癌疗法,包括bortezomib (Velcade),用于治疗多发性骨髓瘤和各种类型的淋巴瘤。Pevonedistat也改变肿瘤细胞修复受损DNA的能力,”他说。
国王和他的同事们为44病人在第一阶段的临床试验,与复发/难治性17多发性骨髓瘤27与复发/难治性淋巴瘤。27名患者接受剂量的升级pevonedistat安排,天一,二,八,九21天的周期,和17如期收到升级的剂量的治疗B,这是天,4、8、11一个21天的周期。
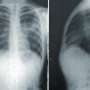
3例患者取得了局部反应:有复发结节性硬化症霍奇金淋巴瘤,一个与弥漫型大b细胞淋巴瘤复发,复发外周t细胞淋巴瘤。另一个30例,17日与淋巴瘤和多发性骨髓瘤和13,实现稳定的疾病。
最大耐受剂量是110和196毫克每平方米如期A和B,分别。严重不良事件,包括贫血、中性粒细胞减少和肺炎,由八个病人经历了在每一个计划。
Shah说,“从我们的研究最重要的发现是,pevonedistat达到目标在癌症细胞的患者,可以考虑到安全,并适度活动严重预防复发/难治性淋巴瘤患者,建议我们在正确的道路。尽管pevonedistat适度活动作为单药治疗,我们期待更大的活动当它与标准疗法相结合,和有很多组合目前在临床测试急性髓系白血病。"
“药效学数据显示pevonedistat达到其目标癌症细胞在低剂量的病人,”他补充道。“这很重要,因为它可能意味着我们不需要升级在今后的试验中剂量增加抗癌活性;这有可能增加风险:pevonedistat受益比率。”
沙阿说,研究人员非常感激所有的参加和其他试验的患者因为没有病人,癌症不能取得进展。
根据沙,本研究的一个限制是,这是一个第一阶段临床试验注册只有少量的病人,他们非常严重进行预处理,这可能限制的评估多活跃pevonedistat。
这项研究发表在临床癌症研究,美国癌症研究协会杂志》上。