新的NTRK靶向治疗显示出早期对抗NTRK基因融合肿瘤的希望
根据11月5日至9日在AACR-NCI-EORTC分子靶点和癌症治疗国际会议上公布的I期临床试验数据,研究性抗癌治疗loox -101靶向一种称为神经营养酪氨酸激酶受体(NTRKs)的蛋白质家族,是安全的,可耐受的,并在患有特定类型的NTRK遗传改变(称为基因融合)的肿瘤患者中显示出临床活性迹象。
“先前的研究表明,NTRK基因融合在临床前模型中驱动肿瘤的生长,并在广泛的肿瘤类型中被发现,”位于休斯顿的德克萨斯大学MD安德森癌症中心研究癌症治疗系副主席兼副教授David S. Hong医学博士说。“这些初步结果来自NTRK靶向研究剂LOXO-101的首次人体临床试验,有助于验证NTRK基因融合作为几种癌症类型的驱动因素,并表明LOXO-101对这些患者来说是一种安全、可耐受且潜在有效的选择。”
截至2015年10月20日,在迄今为止参加I期临床试验的30例患者中,有6例肿瘤NTRK基因融合阳性。截至该日期,这6名患者中有3名患者在开始LOXO-101后进行了疾病评估,根据RECIST 1.1标准,这3名患者在首次疾病评估时均有部分缓解。这三名患者是参与试验的仅有的有反应的患者。所有三个部分反应都在进行中。另外三名NTRK融合的患者仍在研究中,并将在未来几周内对他们的疾病进行评估。
“我们特别兴奋的是,我们已经看到NTRK阳性的不同类型肿瘤患者的显著反应基因融合因为这看起来像是一种潜在的靶向或精确治疗,无论癌症类型如何,都可以在匹配的基因改变水平上有效。”Hong说。“基于这些数据,最近启动了一项II期篮子试验,测试LOXO-101作为NTRK基因融合阳性肿瘤患者的治疗方法。”
所有参与当前临床试验的患者都患有实体瘤,对标准治疗没有反应。该试验是标准的3 + 3剂量递增I期临床试验,LOXO-101在28天周期内每天口服一次或两次。
LOXO-101对迄今为止测试的五种剂量都有良好的耐受性:每天一次50 mg、100 mg和200 mg,每天两次100 mg和150 mg。最大耐受剂量尚未确定。最常见的不良事件有1级和2级疲劳、头晕、贫血和恶心。
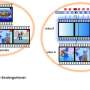
三名NTRK基因融合阳性肿瘤患者接受了100mg或150mg LOXO-101,每天两次,仍在研究中。一名LMNA-NTRK1基因融合的未分化肉瘤患者在8个月后得到确认的部分缓解。一名c-kit阴性胃肠道间质瘤患者经ETV6-NTRK3基因融合后,在4个月后得到确认的部分缓解。一名接受ETV6-NTRK3基因融合的乳腺类似物涎腺分泌癌患者在3个月后仍有部分缓解。
Hong解释说,目前研究的主要局限性是它是一个小型的I期临床试验,只评估了三个病人NTRK基因融合阳性肿瘤。他补充说,尽管这些结果非常有希望,但还需要更大规模的研究来验证。