小儿轻度神经胶质瘤与CRAF融合可能需要微分和组合靶向治疗
与小儿轻度神经胶质瘤(PLGG)由于BRAF融合蛋白,PLGGs所驱动的其他形式的英国皇家空军的融合蛋白,称为CRAF融合蛋白,可能不会回应与fda批准单药治疗,临床实验的英国皇家空军抑制剂,表明分子作为分层的重要性PLGG病人为了确定适当的治疗,根据临床前数据呈现在AACR-NCI-EORTC国际会议上分子靶和癌症治疗,11月5 - 9日举行。
研究还发现,临床前模型的PLGG CRAF融合反应的组合疗法针对两个不同的信号通路,MAPK通路和PI3K通路。
“尽管是儿童最常见的脑肿瘤,PLGGs研究和松散分类相当糟糕,”Payal Jain说,宾夕法尼亚大学的研究生在实验室的亚当·雷斯尼克博士,神经外科助理教授,在费城儿童医院的。“当前治疗可以入侵和有毒PLGGs孩子从长远来看。因此,有一个伟大的需要学习驾驶PLGGs的遗传和分子机制。这将有助于定义小说精密医学方法影响孩子,”她补充道。
Jain说BRAF和CRAF相关信号蛋白参与细胞增长途径称为mitogen-associated蛋白激酶,或MAPK通路,这通常是影响在人类癌症。PLGGs显示突变推动MAPK途径的结合。虽然BRAF融合中发现超过50%的患者PLGG, CRAF融合在一些PLGGs最近才被发现,她指出。
“我们的目标是描述,首次PLGG细胞和动物模型的反应与CRAF融合多样,临床相关的英国皇家空军和MAPK抑制剂,”Jain说。“我们发现,与BRAF PLGGs融合相比,对第二代皇家空军抑制剂疗效所证明的那样,与CRAF PLGGs融合仍很大程度上反应迟钝。”
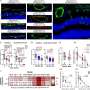
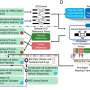
研究CRAF融合PLGGs,耆那教,雷斯尼克,和同事产生不同的细胞模型系统带有明显的CRAF融合患者中发现的。BRAF融合一样,他们发现CRAF融合可以激活MAPK通路在细胞模型和驱动这些细胞在小鼠注射肿瘤形成。
研究人员然后测试和比较的有效性PLX4720 (vemurafenib的研究版本,第一代皇家空军抑制剂),PLX8394(第二代RAF抑制剂)和GSK1120212 / trametinib (MEK抑制剂、蛋白质参与MAPK通路)在抑制细胞培养生长和小鼠肿瘤形成由CRAF融合。在第一或第二代皇家空军抑制剂不能抑制细胞生长受CRAF融合,肿瘤在小鼠部分响应MEK抑制剂,抑制MAPK通路。
研究人员还测试了MEK抑制剂和mTOR的抑制剂,参与PI3K信号通路的分子,并观察显著减少CRAF fusion-driven小鼠的肿瘤生长,表明MAPK和PI3K通路的双重目标是必不可少的有效的治疗反应在PLGGs CRAF融合。
“我们的工作表明,儿童PLGGs不同RAF融合可能需要不同的治疗方法,融合设置在实体肿瘤可能代表一个组合一系列机制受雇于癌症,”Jain说。“小儿轻度神经胶质瘤例证为什么精密医学癌症治疗方法可以是至关重要的。”
Jain说,这项研究的一个限制就是缺乏patient-derived PLGG细胞系,尽管大量研究人员的努力。它标志着一个重大的障碍在研究这些肿瘤及相关分子机制,她说。然而,模型系统中使用当前的研究已经证明了预测的临床反应,她补充道。