肌萎缩性侧索硬化症药物发现的新研究打开了新的大门
创建治疗没有任何疾病,科学家需要学习和理解生物学问题背后的驱动力。今天,北卡罗莱纳大学医学院的研究人员宣布,首次以证据为基础的描述神经元蛋白质聚集被认为是重要的肌萎缩性脊髓侧索硬化症(ALS),也被称为卢伽雷氏症,一种致命的神经退行性条件。
今天在网上发表的这项研究中,美国国家科学院院刊》上,还提供了第一个明确的证据表明,这些蛋白质团的确是有毒的类型神经元死在ALS患者。
本研究发展可能是至关重要的一步发展药物停止块的创建和阻止疾病的进展。治疗ALS和其他神经退行性疾病一直困扰着研究人员,很大程度上是因为他们的原因一直是神秘的。
“最大的一个谜题在卫生保健是如何解决神经退行性疾病;不像许多癌症和其他条件,我们目前对这些神经退行性疾病,没有利用“高级研究作者,Nikolay Dokholyan博士说,迈克尔·胡克杰出的北卡罗来纳大学的生物化学和生物物理学教授。“这项研究是一个重大突破,因为它揭示了运动神经元死亡和可能的起源非常重要的药物发现。”
ALS患者遭受逐渐瘫痪和早期死亡结果的损失运动神经元,这是至关重要的移动、说、吞咽和呼吸。
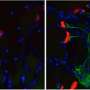
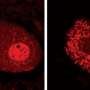
研究关注的一个子集ALS病例——估计有1 - 2%——与蛋白质称为SOD1的变化。然而,即使在患者没有SOD1基因突变,这种蛋白质形成潜在的有毒的团。研究者发现的蛋白质形成暂时的三块,称为“三聚物,”,这些团能够杀死电动机neuron-like在实验室细胞生长。
“这是一个重大的一步,因为没有人知道什么有毒交互背后的ALS患者的运动神经元的死亡,”伊丽莎白说学监,博士研究生在Dokholyan的实验室的学习和论文的第一作者。“知道这些三聚是什么样子,我们可以试着阻止他们形成设计药物,或削减他们才能造成伤害。我们非常兴奋的可能性。”
科学家们将全部注意力放在SOD1基因突变影响蛋白与肌萎缩性侧索硬化症之后在1990年代早期。但聚合蛋白的确切形式负责杀死神经元已经很难识别,和许多的团几乎被认为是有毒的分解形式,就使其研究非常困难。
“这是什么使他们如此认为的部分有毒是他们的不稳定,”天天p说,现在是麻省理工学院博士后研究员。“他们不稳定的特性使得他们更多的活性部位的细胞,他们不应该影响。”
直到现在,研究人员不知道这些短暂的块或他们可能会如何影响细胞的样子。
破解这个谜团,研究小组使用的组合计算建模和实验在活细胞中。普洛克特花了两年时间开发一个自定义算法来确定三聚的结构,一个方面研究Dokholyan描述为“一位杰出的绝技”类似于映射的结构纱线球之后的片段只是它的最外层,然后找出他们如何组合在一起。
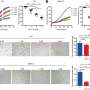
一旦三聚的结构建立,团队花了数年时间开发方法来测试三聚的影响电动机neuron-like在实验室细胞生长。结果很明显:SOD1蛋白质被紧密地绑定到三是致命的马达neuron-like细胞,而non-clumped SOD1蛋白质。
团队计划进一步研究包含三聚“粘”在一起,为了找到药物,可以把它们分开或阻止他们形成。
此外,这些发现有助于阐明其他神经退行性疾病,如阿尔茨海默氏症和帕金森氏症。
“神经退行性疾病之间有很多相似之处,”Dokholyan说。“我们这里发现似乎证实了关于阿尔茨海默氏症,如果我们能找到更多关于这是怎么回事,我们可能会打开一个框架能够理解其他的根源神经退行性疾病。"
进一步探索