TET蛋白有助于维持基因组的完整性
TET (ten- 11易位的缩写)家族成员多年来一直被认为是肿瘤抑制因子,但它们如何控制癌细胞不受控制的增殖仍不确定。现在,拉霍亚过敏与免疫学研究所的研究人员证明,TET蛋白共同构成了一类主要的肿瘤抑制因子,是维持基因组不稳定所必需的。
这项研究发表在最新一期的自然通讯研究表明,同时缺乏Tet2和Tet3的小鼠会迅速发展成一种侵袭性髓系白血病。“我们通过给老鼠注射化学物质来去除Tet2和Tet3基因,在这之后,我们可以在一周内看到癌症的迹象,在四周内看到全面传播癌症的迹象,”该研究所信号和基因表达部门的教授Anjana Rao博士说,她领导了这项研究。“这证明了tet功能的丧失直接导致了恶性肿瘤。”
Tet2基因编码在髓系恶性肿瘤患者中经常发生突变,髓系恶性肿瘤是一种恶性肿瘤白细胞即使没有Tet2突变,许多人类髓系癌症显示出较低的TET功能,正如Rao和她的团队在早期研究中所显示的那样(Ko等人,自然2010年)。该研究的合著者Myunggon Ko博士说:“许多其他类型的癌症也是如此。”他曾是饶实验室的博士后研究员,现在是韩国蔚山国家科学技术研究所的助理教授。“因此,我们的数据表明TET功能可能不仅对预防髓系癌症很重要,而且对潜在的其他类型的癌症也很重要。”
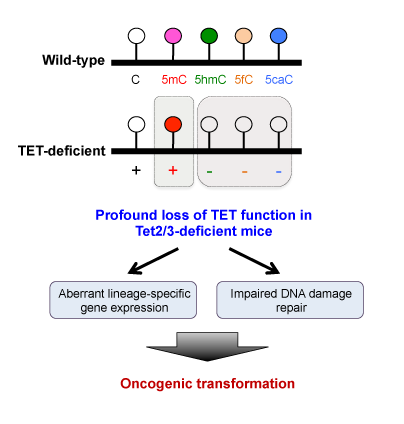
TET家族酶的成员帮助改写表观基因组,表观基因组是位于基因组顶部的化学修饰的调节层,在不改变DNA字母的情况下帮助确定基因活性。具体来说,TET酶将DNA四碱基之一的胞嘧啶(5 -甲基胞嘧啶(5mC))的一种修饰形式转化为5-羟甲基胞嘧啶(5hmC)和其他形式的氧化甲基胞嘧啶。这些氧化形式的5mC一起促进DNA去甲基化,但它们本身也很重要。
“我们的研究结果表明,TET功能的丧失会导致血液倾斜干细胞通过调节谱系特异性基因的表达,有利于形成髓系细胞,而不是其他血细胞类型,”Ko说。“令人惊讶的是,尽管胞嘧啶甲基化一直被认为可以抑制基因的活性,但DNA甲基化与基因的活性之间并没有明显的关联基因表达.它们是独立控制的,我们可能不得不改变我们对DNA甲基化和基因表达之间关系的看法。”Rao补充说:“一种可能性是,沉淀因素是氧化甲基胞嘧啶的损失,而不是DNA甲基化本身的变化。”
仅仅删除TET家族三个成员中的一个(Tet1, Tet2和Tet3)——尽管在一个模型系统中不足以诱导完全的白血病——就会导致产生所有血细胞的干细胞的膨胀。在TET功能受损更严重的干细胞中,这一过程会加剧,如在本研究中同时缺乏Tet2和Tet3的小鼠中所见。自我更新能力增强,细胞优先分化为髓系细胞,如巨噬细胞和中性粒细胞。
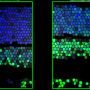
研究人员还观察到DNA损伤修复的强烈损伤,这表明TET蛋白在维持基因组稳定性方面发挥着重要作用。“基因组不稳定是大多数癌症的决定性特征,是DNA损伤修复缺陷的直接结果,”Ko说。“我们还不知道TET功能丧失是如何导致DNA损伤修复受损的。”
进一步探索