科学家发现了阿尔茨海默病的触发器
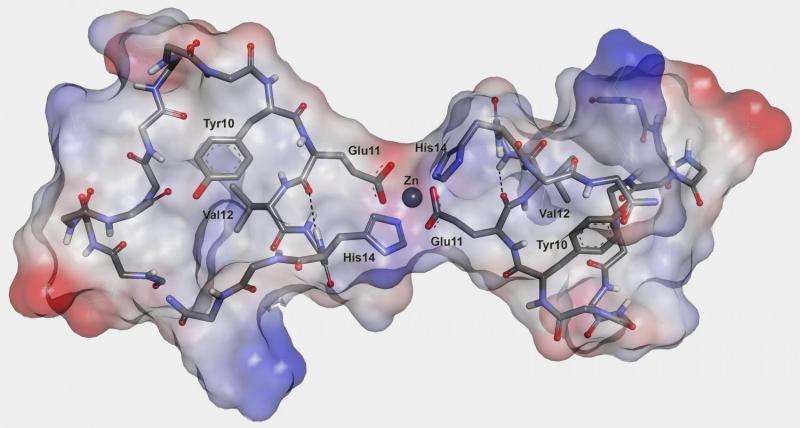
罗蒙诺索夫莫斯科国立大学的一组科学家,与来自分子生物学研究所、俄罗斯科学院和伦敦国王学院的同事一起,确定了阿尔茨海默氏症发展的机制,并可能区分了它的关键触发因素。他们的文章发表在科学报告。
“阿尔茨海默氏症是一种广泛存在的中枢神经系统退行性损伤,会导致心智能力的丧失。直到现在,它被认为是不可治愈的,”密西根州立大学基础医学院的主要研究者Vladimir Polshakov说。现在,科学家们已经区分了导致阿尔茨海默氏症发展的机制,他们已经探索了一些新的化合物,可能作为一种有效的治疗方法。
几个假设致力于阿尔茨海默病的疾病发展。其中一种最常见的是所谓的淀粉样蛋白假设。
淀粉样蛋白(精确,β-淀粉样蛋白肽)是蛋白质类型的分子结构;在正常的健康状态下,它们保护脑细胞。在完成它们的功能后,它们会被蛋白酶清除,这种清洁酶会将所有使用过的蛋白质元素切割成无害的“渣”,进一步回收或从身体中移除。然而,根据淀粉样蛋白假说,在某一时刻,出现了一些问题,淀粉样蛋白开始聚集,从而脱离了蛋白酶的切割刀片。然而,β -淀粉样蛋白转化为有害有机产品的早期阶段大多未被探索。
Vladimir Polshakov说:“例如,我们知道在启动这一过程中,几种过渡金属离子起到了关键作用,特别是锌。”“锌实际上在大脑中执行一些有用的功能,尽管在这种情况下,它是…是一系列过程的发起者,最终导致阿尔茨海默氏症。然而,尚不清楚在互动过程中到底发生了什么锌离子与肽分子,或何种氨基酸结合锌离子,以及这种相互作用如何规定肽聚集。我们的目标是至少澄清其中一些问题。”
科学家们研究了各种致病性β -淀粉样肽及其所谓的金属结合域——能够结合金属离子的相对较短的肽区域。研究人员使用了许多实验技术,包括核磁共振(NMR)光谱,这被用来确定形成的分子复合物的结构。另外还在伦敦测量了一些灵敏度较高的光谱。波尔沙科夫说,选择研究的病原体“部分是出于运气”。其中一个样本是所谓的“英国突变”肽的产物,类似于普通的-淀粉样肽,但有一个氨基酸替代。通过核磁共振波谱,科学家们确定了当肽分子与锌离子相互作用并发生进一步聚集时发生的化学过程和结构变化。
第二种病原体是异构化β-淀粉样肽。其一种氨基酸残基天冬氨酸具有特定原子位置。这种异构性自发地发生,而不会发生任何酶的帮助,并且与老化过程有关,阿尔茨海默病的另一个影响因素。来自莫斯科分子生物学研究所的同胞生物学家最近显示给将异构化肽施用于转基因小鼠导致淀粉样蛋白斑块的加速形成。随着锌离子的存在,通过如异构化肽的金属结合结构域聚集,使成形结构难以检测。尽管在锌离子存在下发生的“英语突变体”和异构化肽的过程中的所有差异,但这些转化的初始阶段是相似的。触发器恰好是相同的 - 致病聚集种子的作用在初始形成的肽二聚体中的两种情况下,即均在锌离子的帮助下彼此连接。在正常的人肽中也检测到这种二聚体,并且可以通过相应二聚体的形成速度来解释所有研究形式的差异,并且其对进一步聚集的速度来解释。
基于他们的发现,研究人员提出了肽保护剂锌对抗转化为肽杀伤的机制。科学家们注意,这种机制解释了先前研究的多个实验数据。研究人员还希望他们的发现可以帮助生产新药来阻断由锌离子规定的β-淀粉样肽聚集体。












用户评论