研究小组报告了一个新的小鼠模型来研究EWS-FLI1基因是如何导致骨癌的
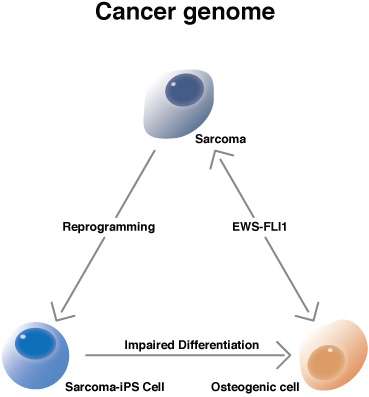
有几个致癌基因驱动癌症。然而,在许多情况下,癌基因本身是不够的,在癌症发生之前必须与其他突变相辅相成。日本京都大学iPS细胞研究与应用中心的研究人员利用细胞重编程技术将癌细胞还原为干细胞状态。研究人员表示,与特定致癌基因结合的功能失调分化可以解释某些骨癌的原因。
不像正常细胞,癌症细胞无法控制地扩散,导致它们遍布全身。这种不规则增生通常归因于突变基因。京都大学诱导多能干细胞研究与应用中心(CiRA)的Yasuhiro Yamada教授对一种与诱导多能干细胞相关的基因特别感兴趣骨癌。“我们的一个项目是EWS-FLI1基因,”他说。这种致癌基因被认为是多种骨癌的必要但并不足够,这意味着它必须与其他突变一起导致癌症。
“诱导多能干细胞”技术为癌症研究人员提供了一个重新编程细胞的工具,从而使研究人员能够实时观察癌症的发展。“我们可以修改iPS细胞的基因,然后将它们进行分化,以评估突变的重要性,”Yasuhiro Yamada教授说,但他补充说,“大多数肉瘤(或癌细胞)都对重编程具有抵抗力。”对他的实验室来说,幸运的是,他发现了一些不是这样的肉瘤。
为了识别与EWS-FLI1合作的其他突变,他的实验室进行了一项近乎绝望的实验。他们插入胚胎干细胞EWS-FLI1基因,并将这些细胞植入正常小鼠体内。该细胞的一个重要特征是,EWS-FLI1基因除非被抗生素激活,否则不会表达,但无论如何,小鼠都不能生长肿瘤。“这证明了其他突变是必要的,”山田解释说。然而,当EWS-FLI1基因随机加入突变时,当EWS-FLI1基因被激活时,小鼠生长的肿瘤与骨肉瘤一致,骨肉瘤是一种骨癌。然后,研究人员试图将肿瘤细胞重新编码为iPS细胞(肉瘤-iPS细胞),并在两个病例中获得成功。
获得肉瘤诱导多能性细胞使科学家能够观察额外的突变如何影响细胞分化。在未激活EWS-FLI1基因的肉瘤- ips细胞中,未形成肿瘤,但发现异常分化。“成骨细胞[继续产生骨细胞没有正确地发展,”山田说。当EWS-FLI1基因被激活时,细胞开始形成肿瘤。山田猜测未知突变影响成骨细胞的分化,这一机制是导致EWS-FLI1基因致癌的原因。因此,他提出,肉瘤诱导多能干细胞可能对药物研发有价值,因为纠正分化的化学物质可以防止骨癌的形成,即使是在EWS-FLI1基因表达的情况下。他说:“这个平台将有助于找到用于治疗的小化合物。”
进一步探索











用户评论