靶向两种血管生成途径可提高胶质母细胞瘤的治疗效果
来自马萨诸塞州总医院(MGH)研究团队的两篇相关论文表明,同时针对多种血管生成途径可以帮助克服破坏性脑瘤胶质母细胞瘤不可避免地产生的抗血管生成治疗的耐药性。出现在PNAS早期版本的报告描述了两种不同的方法如何同时抑制动物模型中的血管内皮生长因子(VEGF)和血管生成素-2 (Ang-2),不仅在更大程度上使肿瘤血管正常化,而且还将肿瘤浸润免疫细胞的作用从促肿瘤状态转变为抗肿瘤状态。
“这些论文提供了一个潜在的解决方案胶质母细胞瘤MGH放射肿瘤科斯蒂尔肿瘤生物学实验室主任、两篇论文的共同通讯作者Rakesh K. Jain博士说:“这是通过激活替代生长因子途径介导的。“在我们背靠背的论文中,我们不仅提供了对偶的原理证明数据治疗策略可以减缓胶质母细胞瘤的生长,提高生存率,但也揭示了这些好处的潜在机制。”
胶质母细胞瘤是发生在大脑中最常见的恶性肿瘤,其特征是血液供应高度异常、渗漏和效率低下,由血管生成因子如VEGF的过度表达引起。这些血管异常导致肿瘤周围肿胀,肿瘤内部血液灌注不良,使肿瘤变得更具侵袭性,对化疗和放疗产生抗药性。虽然抗vegf治疗已成为胶质母细胞瘤术后标准治疗的一部分,但其有益作用是暂时的,并不能延长患者的生存期。
这些MGH团队之前的研究显示,接受抗vegf治疗的胶质母细胞瘤患者血液中Ang-2水平也有短暂下降。随着肿瘤进展的恢复,该因子水平反弹,这表明Ang-2活性可能有助于抗vegf治疗的耐药性。研究人员还发现,与VEGF相似,所有类型的胶质母细胞瘤都表达Ang-2。为了捕捉不同胶质母细胞瘤类型的多样性,研究人员设计了两种方法来测试抑制这两种途径是否可以克服治疗阻力。
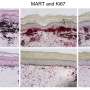
一种方法是联合使用实验性口服抗vegf药物cediranib和ang -2中和抗体治疗两个胶质母细胞瘤小鼠模型,发现与单独治疗cediranib相比,双重治疗改善了血管正常化,延长了生存期。双重治疗也吸引肿瘤相关巨噬细胞(TAMs)到肿瘤,并增加抗肿瘤形式的免疫细胞的比例。重要的是,阻断TAMs向肿瘤的迁移降低了双重治疗的益处。
第二项研究使用了一种靶向VEGF和Ang-2的抗体,结果表明双重治疗改善了血管异常小鼠模型的肿瘤血管结构。在这个肿瘤模型和另一个没有血管异常特征的模型中,TAMs被重新编程到抗肿瘤状态,这表明血管正常化不是唯一的获益机制。事实上,双重治疗通过将TAMs人群转移到抗肿瘤形式,促进了抗肿瘤免疫,这与第一项研究一致,但不管周围血管是否异常。
哈佛医学院肿瘤生物学Andrew Werk Cook教授Jain说:“我们的研究表明,VEGF和Ang-2的双重靶向治疗可以克服目前可用的胶质母细胞瘤治疗的一些缺点。”“目前,临床可获得的药物可用于这种双靶向策略,我们的发现,双重治疗也可以提高抗肿瘤鉴于新的免疫疗法的迅速发展,免疫反应,不管它对血管的影响,是特别及时的。这些结果为新型组合的研究开辟了新的途径,以获得对抗这种毁灭性疾病的更持久的结果。”
进一步探索
Ang-2/VEGF双特异性抗体重编程巨噬细胞和驻留小胶质细胞以抗肿瘤表型并延长胶质母细胞瘤生存时间PNAS,www.pnas.org/cgi/doi/10.1073/pnas.1525360113