基因调节突变与稀有儿童癌症相关联
基因中的单一缺陷,其用于组蛋白-A“丝阀”,其包裹着怠速DNA - 与今天发表的研究中的儿科癌症联系在一起科学。
“与需要多次命中的大多数癌症不同,我们发现这种特殊的突变可以自行形成肿瘤,”威斯康星大学医学和公共卫生学院的生物分子化学助理教授彼得W.Lewis。麦迪逊。
组蛋白从相同的基因组中得出他们的模式,他们有助于包装和组织。“组蛋白的日间工作正在压缩基因组,”刘易斯说。“组蛋白占六英尺的DNA,并将其包装在直径几微米的东西中。”
路易斯开始研究组蛋白突变在2013年抵达UW-Madison的威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州威斯康星州。,他和同事发现了与称为DIPG的致命脑肿瘤相关的组蛋白突变的机制。
由于DIPG突变总是改变组蛋白基因中相同位置的相同氨基酸,刘易斯知道它有一些特殊之处。
组蛋白在激活或沉默基因的“Rube Goldberg”级联中发挥作用。在这些过程中,组蛋白中布满了特定的化学基团,这些化学基团吸引蛋白质,进而引发进一步的事件。
最终结果可能是蛋白质形成,另一个使用DNA的过程,或者使DNA逆转和沉默的机制。
在目前的研究中,刘易斯和同事展示了组蛋白突变的非凡力量。“没有人认为将发现单一的组蛋白突变会导致癌症,因为你从每个父母那里得到15份组蛋白基因,”他说,这些其他基因可能会弥补单一突变。
在先前的DIPG工作中,Lewis发现突变会导致组蛋白抑制酶PRC2,其通过压缩它们来灭活基因。然而,如果PRC2本身被组蛋白突变抑制,Lewis说,这种沉默作用会丧失,“这导致异常的基因表达。”
基因沉默是必不可少的。虽然几乎所有的人类细胞类型包含了我们20000多个基因中的每一个,“大多数在任何特定的细胞类型中都是封闭的,因为它们是打包的,不能作为蛋白质的模板,”刘易斯说。
2014年,刘易斯和同事表明,称为K27的位置的组蛋白突变可以阻断神经干细胞的分化,使其保持在最容易受控制的生长的原始状态。
不久之后,英国的一个研究小组发现,95%的成软骨细胞瘤(一种罕见的青少年骨癌)在组蛋白基因的K36位置含有类似的突变。
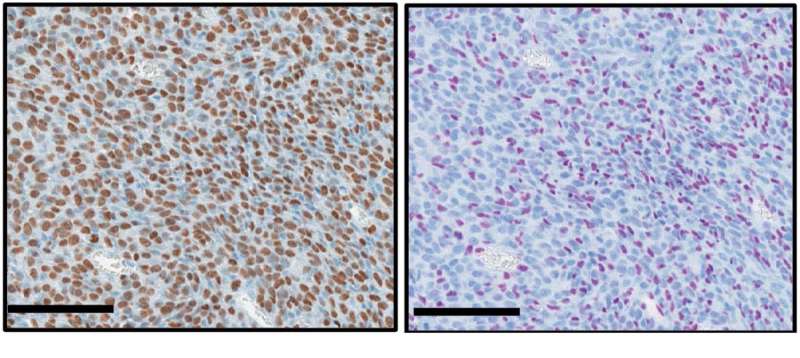
新科学研究集中在K36突变上,该突变阻碍了可形成软骨、骨骼和脂肪的干细胞类型的特化。当研究人员将该突变插入小鼠体内时,结果是一种未分化的儿童肉瘤(结缔组织癌),这可能是由于K36突变导致干细胞发育停滞所导致的。
刘易斯和他来自洛克菲勒和麦吉尔大学的同事们也从未分化肉瘤中筛选人类组织,发现20%的样本中有相同的K36突变。刘易斯说:“我们在老鼠身上学到的东西反映在人类疾病中,这不仅仅是一些奇怪的老鼠人工制品。”
虽然少数基因突变本身足以引发癌症,但“这是首次证明组蛋白基因突变本身会引发癌症,”刘易斯说。他说,结果更加令人震惊,“因为有29个完整的组蛋白基因,而在成人肿瘤中通常存在的其他突变没有出现。”这就是我们所说的显性否定;烂苹果烂桶。这些都是非常强大的突变。”
刘易斯说,这种关于特定癌症的基本知识对于开始药物测试是必不可少的。“除非你有这个模型,否则你要从哪里开始呢?”
受组蛋白突变影响的酶“已经涉及许多常见的癌症,”刘易斯说,他与制药公司合作,发现“突变组蛋白是如何抑制这种酶的”。
抑制PRC2的药物可能能够治疗转移性乳腺癌,其中酶可能过度活跃。
除了癌症之外,刘易斯注意到组蛋白修改“与其他机制结合使用,因此对于更加了解人类发展,这一般更重要。”
进一步探索












用户评论