2016年5月6日报告
发现了使细胞对良性肠道细菌和omv的信息充耳不闻的基因之间的关系
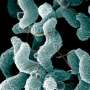
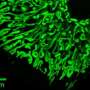
(欧宝娱乐地址医学Xpress)-A研究人员团队,来自美国的几个实例。已经发现人类中的两个缺陷基因与从一种良好的细菌和肠易激综合征(IBS)中发送的信息之间的联系。在他们的论文中发表在期刊上科学,该团队描述了他们用小鼠,分离的人体细胞和人体肠道中发现的细菌的研究伯曲面脆弱。
之前的研究已经证明了这一点b . fragilis是一种“好”细菌,这意味着它是有益的,而不是造成问题——其他研究发现,克罗恩病患者的两个特定基因NOD2和ATG16L1存在缺陷,这两个基因会引发或不能预防肠道炎症,从而导致问题。但目前还不清楚的是,这些有缺陷的基因是如何导致这种疾病的。在这项新研究中,研究人员已经确定了这一过程的主要部分。
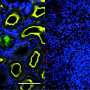
通过改变小鼠的基因使其具有人类缺陷的NOD2和ATG16L1基因,然后仔细观察发生了什么,该团队能够看到这一点b . fragilis实际上有助于预防与克罗恩病和ibs相关的炎症——在引入没有缺陷基因的小鼠肠道后,他们能够看到这些细菌发出含有免疫调节成分的小包,称为外膜囊泡(OMVs)分子它们进入了免疫系统,抑制了炎症。但是,在含有NOD2和ATG16L1基因的小鼠中,这些分子未能进入免疫系统,这凸显了缺陷基因导致肠道问题的途径。
研究人员还报告了这种隔离人类免疫细胞与缺陷基因也没有对同一类型的omv做出反应。但是,该小组还发现,如果分子直接喂养老鼠,而不是依靠运输的使者,他们在免疫系统表明NOD2传输机制和ATG16L1基因导致问题不是分子或它们之间的通信免疫系统。
该团队的发现还表明,有可能创造出一种治疗肠道问题的人类患者可以摄入的分子——通过绕过运输问题,这种分子将提供与那些没有遗传缺陷的患者相同的抑制炎症的好处。
进一步探索
摘要
炎症性肠病(IBD)与人类基因组的风险变体与肠道微生物组的脱泻病有关,尽管这些发现的统一原则仍然很大程度上是未被描述的。人类共生Bacteriodes Fragilis通过分泌外膜囊泡(OMV)来提供免疫调节分子以免疫细胞。我们揭示OMV需要IBD相关基因,ATG16L1和NOD2,在保护过程中激活非规范的自噬途径。ATG16L1缺陷的树突细胞不会诱导调节性T细胞(Treg)以抑制粘膜炎症。来自ATG16L1中具有主要风险变量的人受试者的免疫细胞在Treg16L1中有缺陷对OMV的反应。我们提出易感性基因的多态性通过从微生物组的“感测”保护信号中的缺陷促进疾病,定义了IBD的潜在关键的基因环境病因。
©2016医学欧宝娱乐地址快讯









用户评论