朝着Herpesviruses的治愈方法:针对CRISPR / CAS9的靶向感染
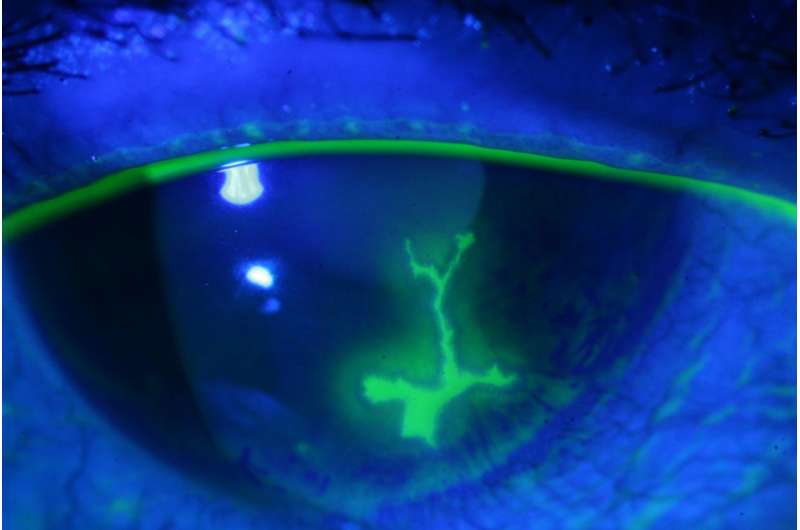
大多数成年人携带多种疱疹病毒。在初始急剧感染之后,这些病毒在其宿主中建立了终身感染,并导致唇疱疹,角膜炎,生殖器疱疹,瓦疱疹,传染性单核细胞多症和其他疾病。一些疱疹病毒可导致人类癌症。在感染的潜在阶段期间,病毒在长时间保持休眠,但保留偶尔再激活的能力,这可能导致疾病。一项研究于6月30日发表PLOS病原体表明,用CRISPR / CAS9基因组编辑技术攻击Herpesvirus DNA可以抑制病毒复制,并且在某些情况下,导致消除病毒。
CRISPR / CAS9系统靶向特异性DNA序列,并在DNA的两个股线上诱导干净的切口。在哺乳动物细胞中,通过称为NHEJ的紧急修复系统标记并快速修复这种切割(用于非同源终端连接)。NHEJ是高效但不是非常准确,并且通常导致在修复部位插入或删除几个DNA碱基。因为一次在三个碱基密码子中读取DNA,因此临界位置的这种小变化通常会破坏各种基因及其蛋白质产品的功能。
来自荷兰乌特勒德大学医疗中心的Robert Jan Lebbink以及同事推出了Crispr / Cas9可以在受感染的人体细胞中靶向和突变潜在的疱疹病毒DNA,因此可能预防疱疹病毒相关疾病。为了测试这一点,研究人员设计了对病毒基因组的重要部分互补的特定指南(G)RNAS序列,并用作“分子地址”。这些GRNA与CRISPR / CAS9系统的“分子剪刀”部分相结合,应诱导疱疹病毒DNA中的特定切割和随后的突变,因此抑制病毒。
在他们的系统方法中,研究人员看着Herpesvirus组的三个不同成员:单纯疱疹病毒1型(HSV-1)引起唇疱疹和角膜炎;人巨细胞病毒(HCMV),出生缺损最常见的病毒原因(当病毒从母体传播到胎儿时);和Epstein-Barr病毒(EBV)引起传染性单核细胞源和多种癌症。
研究人员表明,使用EBV潜在感染的淋巴瘤细胞,旨在引入靶向特异性EBV DNA序列的GRNA可以引入目标位点的突变。这种突变可以消除病毒的基本功能以及脱稳稳定病毒DNA分子。与此符合这一致,研究人员通过使用靶向必需EBV基因的两种不同的GRNA,它们可以从宿主细胞中诱导超过95%的EBV基因组。
在潜在感染期间,HCMV基因组作为宿主细胞核中的圆形DNA分子存在。在病毒重新激活后,HCMV复制缓慢进行。通过适当的GRNA,研究人员发现CRISPR / CAS9编辑可以有效地损害HCMV复制。然而,他们还观察到横跨CRISPR / CAS9编辑的逃生变体的出现,表明在HCMV基因组中的多个关键位点同时编辑是必要的,以避免抗性基因组的发展。
与HCMV相比,HSV-1乘以更快的速度。当研究人员与CRISPR / CAS9一起测试靶向不同的必需HSV-1基因的各种GRNA时,它们发现其中许多人能够减少病毒复制。当它们组合两种GNA时,从而同时靶向两个基因,它们能够完全抑制HSV-1复制。另一方面,它们在潜在期间不能诱导编辑,即当病毒DNA没有主动乘以。
研究人员总结说:“我们观察到eb病毒从潜伏感染的肿瘤细胞中高效特异地清除,以及人类细胞中HSV-1和HCMV复制的损伤。”他们继续说,“尽管CRISPR/Cas9在指导静止HSV-1的基因组工程方面效率低下,但使用抗HSV-1 gRNAs可以有效地消除静止HSV-1重新激活后的病毒复制。”他们希望,他们的结果“可以设计出有效的治疗策略,在潜伏期和生产性感染期间针对人类疱疹病毒。”








用户评论