这一发现可能会带来减缓帕金森病的治疗方法
在伯明翰研究人员和同事的阿拉巴马大学使用帕金森病的强大模型已经发现了有助于帕金森病的神经元的相互作用,他们表明现在正在开发的药物可能阻止该过程。
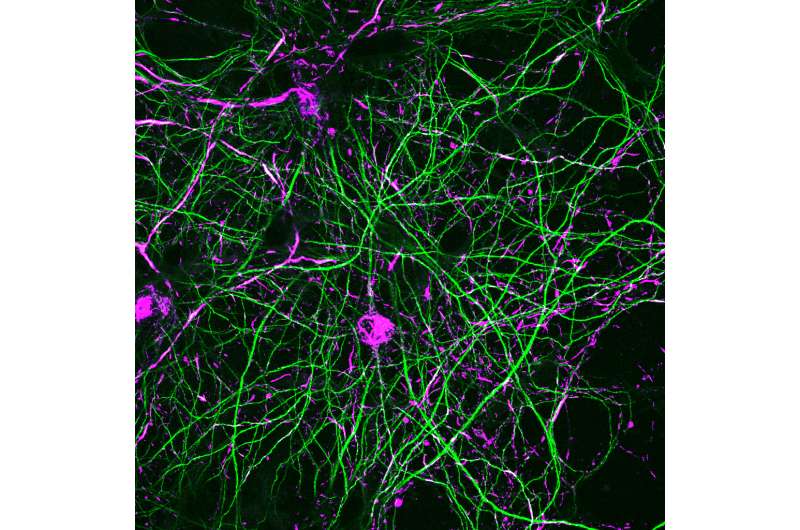
研究小组发现,帕金森氏病最常见的遗传原因——LRRK2激酶的突变——有助于内含物的形成神经元,类似于帕金森病的标志病理之一。这些夹杂物由聚集的α突触核蛋白蛋白组成,该夹杂物组成,该研究还可以通过使用现在正在开发的临床用途的两个LRRK2激酶抑制剂药物来预防 - 可以防止形成。
研究人员在最近的一篇文章中写道,突变LRRK2激酶和α -synuclein之间的相互作用“可能揭示了神经保护的新机制和目标”神经科学杂志纸。“这些结果表明,通过抑制LRRK2激酶活性,可以阻断神经元中的α-突触核蛋白的包合物形成,并且通过抑制LRRK2激酶活性靶向该方法的新型治疗化合物可能会减缓帕金森病相关病理的进展。”
由通讯作者Laura A. volpicellia - daley博士和资深作者Andrew B. West博士领导的研究人员说,新型神经保护策略在lrrk2关联帕金森病中的潜在临床应用需要在帕金森病的其他临床前模型中进行测试。神经退行性变及实验治疗中心,神经内科。
“这些数据给我们希望LRRK2激酶抑制剂的临床潜力为帕金森病的有效疗法,”Volpicelli-Daley说。“LRRK2激酶抑制剂可能抑制病理α-突触核蛋白的扩散,不仅在LRRK2突变的患者中,而且在所有帕金森病患者中。在测试抑制剂之前,需要验证LRRK2抑制剂的安全性和疗效的未来研究人类临床试验。“
除了帕金森病,α-突触核蛋白还在痴呆症的痴呆症和多种系统萎缩方面发挥着核心作用,它与阿尔茨海默病和其他神经变性障碍有关。
研究细节
Volpicelli-Daley开发的帕金森病模型将非常低浓度的α -synuclein预形成原纤维应用于体外或体内神经元。这导致了修饰的α -突触核蛋白包涵体的形成,这些包涵体的形态与死后帕金森氏病的大脑中发现的相同。
它们使用该模型来测试突变体LRRK2(“Lark二”)激酶G2019S-LRRK2的神经元表达对包涵体的形成的影响。
他们发现:
- 与过表达正常LRRK2的神经元相比,G2019S-LRRK2增强了来自大脑海马区的初级海马神经元中的α -synuclein内含物。
- 通过抑制LRRK2激酶的极低浓度和选择性临床前药物,减小G2019S-LRRK2在原纤维暴露神经元中的影响。这表明G2019S-LRRK2的激酶活性,其将磷酸盐添加到靶蛋白质上,底下了病理α-突出核蛋蛋白夹杂物的更快形成。
- G2019S-LRRK2表达增强了α-突触核蛋白的包含形成多巴胺神经元来自于大脑的黑质致密部。黑质致密部是帕金森病中死亡的大脑区域,因此本实验进一步支持了G2019S-LRRK2突变与帕金森病发病之间的联系。
作为对照,他们使用反义寡核苷酸在表达G2019S-LRRK2的神经元中敲除内源性α -synuclein的表达,这阻止了包涵体的形成。
在荧光回收后光漂白实验中,它们发现存在较大的流动α-突触核蛋白,而不是表达G2019S-LRRK2的神经元中的膜结合的α-突触核蛋白。其他人的工作已经表明,移动α-突触核蛋白容易出现错误和聚集,因此研究人员假设G2019S-LRRK2突变可能通过促进神经元中的移动α-突触核蛋白的量来促进帕金森的易感性。
进一步探索












用户评论