原子分辨率的阿尔茨海默原纤维
β -淀粉样蛋白的细长纤维(原纤维)形成了阿尔茨海默病患者大脑中典型的老年斑。一个欧洲研究小组与一个美国研究小组合作,现在已经成功地以原子分辨率解释了β -淀粉样肽1-42的结构,这对这种疾病来说是最重要的。这简化了治疗阿尔茨海默氏症的药物产品的有针对性的搜索。
全球至少60%的痴呆症病例是由阿尔茨海默病引起的。它造成巨大的人类痛苦,并伴随着高昂的代价。目前还没有治愈方法或因果疗法。其中的原因是,在分子水平上,这种疾病在大脑中的确切过程还没有得到充分的阐明。
我们知道β -淀粉样蛋白起着重要作用。这是一种由39到42个氨基酸组成的肽,对神经细胞有毒,并能形成细长的原纤维(纤维)。β -淀粉样肽1-42和β -淀粉样肽1-40是老年斑中出现的两种主要形式。我们不知道为什么这些会导致大脑中神经细胞的衰退,但这对于治疗阿尔茨海默病的药物开发非常有趣。
在苏黎世瑞士联邦理工学院、里昂大学和美因河畔法兰克福歌德大学的联合项目中,研究人员与欧文大学和布鲁克海文国家实验室的同事合作,成功地阐明了β -淀粉样肽1-42原纤维的结构原子分辨率.这种纤维在这种疾病中表现出最大的危险。研究人员还进一步推进了芝加哥大学的工作,涉及β -淀粉样蛋白单体的结构。进一步的免疫学检查证明,所调查的原纤维形式与疾病特别相关。
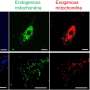
事实上,蛋白质原纤维在电子显微镜图像中是可见的(图1),但很难深入观察原子水平的细节。实现这一目标所需的传统结构生物学方法假设大分子以极其规则的晶体形式存在,或以溶解在水中的单个分子的形式存在。然而,原纤维是一种细长的结构,它们相互粘附,既不能形成晶体,也不能溶解在水中。
在这种情况下,只有固态核磁共振波谱(固态NMR)能够提供原子水平的视图。新方法的发展有助于测量构成纤维的蛋白质分子中原子之间的距离网络(图2)。广泛的计算使纤维的原子结构可以从这些测量中重建。
β -淀粉样蛋白1-42肽的主要部分呈双马蹄形(图3)。同一水平上的两个相同分子相互堆叠形成长纤维。大量平行于长轴的氧桥连接使纤维具有很高的稳定性。
歌德大学(Goethe University)计算机辅助结构生物学教授Peter Güntert解释说:“这种结构与早期的模型研究有根本不同,因为早期的模型研究几乎没有任何实验测量数据。”
这些欧美团队发表的相互证实的论文,在专家圈引起了极大的兴奋,因为他们实现了针对-淀粉样蛋白的药物产品的有针对性的、基于结构的搜索原纤维.110年前,法兰克福医生阿洛伊斯·阿尔茨海默(Alois Alzheimer)首次描述了这种老年祸害的可怕之处。研究人员希望,在未来的一二十年里,这种祸害最终会变得无害。
更多信息:Marielle Aulikki Wälti等。疾病相关a β(1-42)淀粉样纤维的原子分辨率结构美国国家科学院院刊(2016)。DOI: 10.1073 / pnas.1600749113
Michael T. Colvin等人。单形a β淀粉样原纤维的原子分辨结构美国化学学会杂志(2016)。DOI: 10.1021 / jacs.6b05129
肖逸玲等。Aβ(1-42)纤维结构揭示阿尔茨海默病中淀粉样蛋白的自我识别和复制结构与分子生物学(2015)。DOI: 10.1038 / nsmb.2991