呼吁更大的透明度的临床试验数据
研究人员呼吁更大的透明度在临床试验数据的公开发布的一项研究显示重大漏报医学治疗的副作用。
领导的研究中,纽约大学的医疗福利通常报道透露,虽然副作用不完全记录在同行评议的期刊文章。
新药的临床效益通常是测试随机临床试验,病人随机分配接受药物或安慰剂,药物之前广泛的规定。
不良事件或副作用,也定期收集这样的试验,应在科学报道期刊文章给一个明确的新的治疗方法的好处和风险。
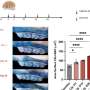
该研究发表在《公共科学图书馆·医学》杂志上发现,64%的副作用会被读者只看错过刊登报道医疗研究。
作者得出结论,全面报道不良事件是必要的让病人和医生评估之间的平衡利益和医学治疗的副作用。
苏高德博士研究员,纽约大学的健康科学部门,说:“我们需要更多的透明度。
“人们需要获得充分的信息从医疗伤害,使他们意识到选择一个特定的治疗的后果。”
在一个例子中,在临床试验中记录四个198人的死亡新药,全部细节死因的参与者可以从制药公司的数据集。在随后发表的论文只有29人死亡充分报道。
在另一个例子,一份未发表的报告记录15自杀在药物治疗的参与者,但其中只有7人在发表论文。
高德博士补充道:“有严重担忧发表研究结果仅代表一个小快照的完整的数据集,这病人和医护人员可能决策基于不完整的信息。”
研究,包括与吉尔·诺曼合作,曼彻斯特大学和Yoon死胡同,东安格利亚大学资助通过国家卫生研究所(NIHR)。