非编码突变破坏了稀有遗传疾病中“基因家族”的合作功能
约翰·霍普金斯(Johns Hopkins)的科学家说,他们更接近了解一种罕见,复杂,多基因疾病的遗传机制,称为赫希斯普伦(Hirschsprung)氏病。他们的最新研究结果表明,当特定基因的基因调节序列中的多个突变结合起来破坏整个基因网络的正常合作功能时,许多患者会发展这种疾病。
研究人员说,他们期望类似功能失调的基因网络会影响涉及多个基因的其他疾病的发作和进展,并且解剖这些网络可能最终会改善癌症,糖尿病和糖尿病,糖尿病和疾病患者的诊断和治疗选择。高血压。
该研究的摘要于9月29日在线发布细胞。
“我们倾向于将基因自行运行,但不能也不是不可行,”主持这项研究的Aravinda Chakravarti博士说,并开创了对所谓多基因元和遗传学的研究。复杂疾病。他说:“相反,它们存在于基因的'家庭中,监管元素它生活在染色体的同一部分并经常相互作用,每个人都有自己的工作,但都朝着一个目标努力:制作基因功能。如果您扰动一个人,其他所有人都会受到影响。”
查克拉瓦蒂(Chakravarti)是约翰·霍普金斯大学医学院的麦克库西克 - 纳塔尔人遗传医学研究所的教授,自1990年以来一直研究过Hirschsprung病,因为它是一种相对易于投资模型,用于具有复杂遗传原因的疾病。例如,该疾病的严重程度和症状范围很广,但单个受影响的器官:结肠。总体而言,当神经细胞在胎儿发育过程中无法连接到结肠的肌肉时,就会发生这种疾病,而孩子无法通过粪便。它影响了大约5,000名新生儿,通常可以通过外科手术解决,但是30%至50%的患者一生仍有并发症。
在2002年和2015年,Chakravarti的团队进行了全基因组协会研究(GWAS),以鉴定与该疾病相关的常见遗传变异。进一步的研究表明,RET基因及其调节元素的变化在患者中是杰出的,因为几乎每个患有Hirschsprung's的人至少具有一个RET相关变体。但是,由于许多没有Hirschsprung的健康人也这样做,因此因果机制仍然是一个谜,并导致他们寻找多因素原因。
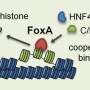
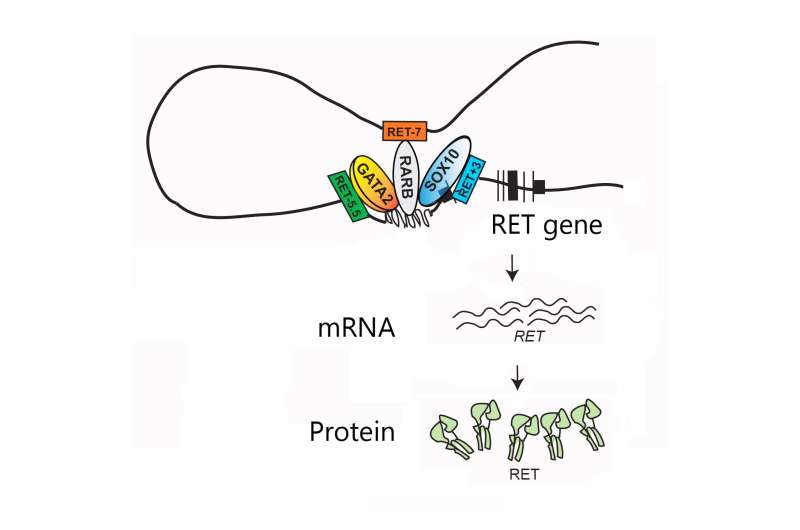
他们决定专注于遗传密码或SNP的八个单一“字母”变化,已知发生在RET基因附近的特定区域。这些所谓的基因增强子像调光开关一样起作用,通过结合和适当定位蛋白来向附近基因的活动或转录,称为转录因子。
在将RET基因换成记者基因之后,科学家在人神经细胞系中进行了一系列测试,并表明只有三个SNP,每个SNP,在不同的增强子中,能够降低基因活性通过削弱该增强子的转录因子的结合来本身。
当科学家以不同的组合测试了三个SNP时,他们发现尽管没有一个增强子可以直接相互作用,但出现了一般趋势:增强子受影响越多,报告基因活性就越低。当团队查看346例HIRSCHSPRUNG病和732个健康对照的患者中这些调节变体的频率时,这一趋势得到了证实。所有三个SNP的人患疾病的风险更高。
在对小鼠的进一步实验中,研究人员说,他们发现这三个增强子在发育中的胎儿肠道中的不同阶段驱动基因活性,并能够识别哪些转录因子与它们结合。然后,他们从小鼠中删除了RET基因,并检查了其“基因家族”的反应。在丢失RET时,将其增强子的两个转录因子的基因(以及将其分解为停止其信号传导的另一种蛋白质)的基因。但是,与RET一起在细胞表面和与RET结合的信号分子一起使用的蛋白质的基因增加了活性。来自人类细胞的数据还表明,降低转录因子的水平会降低RET的水平。
新发表的研究论文的第一作者Sumantra Chatterjee博士说:“这些发现有助于解释为什么重新相关的变体是必要的,但不足以引起Hirschsprung氏病。”“它为在健康障碍背景下研究遗传协同作用提供了前进的道路。”
Chakravarti补充说:“我们能够证明这些基因与彼此之间的密切相关并不是因为序列或功能的相似性甚至我们的基因组中的位置,而是因为它们都共同执行一个功能:使细胞成为结肠的神经细胞。”
该报告的其他作者包括约翰·霍普金斯大学医学院的Ashish Kapoor,Dallas Auer,Dongwon Lee和Courtney Berrios;劳伦斯·伯克利国家实验室的Jennifer Akiyama和Len Pennacchio;和布罗德学院的史黛西·加布里埃尔(Stacey Gabriel)。