从创新缓慢爬到cure-treating贫血基因编辑

能够精确编辑通过CRISPR DNA技术已成为其中一个最强大的生物学的进步。一个新论文显示出基因突变在人类血液细胞的修复是一个重要的一步治疗常见,称为衰弱和治疗费用昂贵血液疾病镰状细胞贫血。
基因疗法已经很长时间了。
其他突破,如维生素、抗生素和疫苗,很快被译成医学疗法。先进的诊断和不同的组合疗法已逐渐改善癌症存活率,艾滋病毒通常可以控制与联合治疗。
但遗传基因突变,导致挥之不去,难住了我们终身疾病。它已被证明比预期的要难得多,将替代基因导入细胞。往往我们的DNA基因组似乎认识到新的外交和关闭。
但CRISPR技术提供了一种全新的方法。我们现在可以修复基因,而在过去基因治疗添加一个替代基因有关。
一个通用的、衰弱和昂贵的疾病
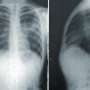
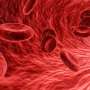
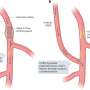
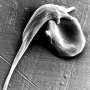
镰状细胞贫血结果发生突变的基因,编码血红蛋白中的蛋白质红色血细胞中含有氧气的人在我们的身体。突变不仅影响蛋白质的功能,但也使其聚合和扭曲细胞形状。这导致血管的细胞团块,产生了灾难性的后果。重要器官受损,中风和巨大痛苦的时期发生,寿命减少了约30年。
输血可以帮助但最终铁过剩——血红蛋白的重要组成部分——积累和组织进一步损坏。终身治疗估计成本几百万美元/病人。
可悲的是,这种疾病是常见的。球蛋白基因突变是最常见的单基因疾病。在美国大约有70000年患者在任何给定的时间,和世界各地200000年的孩子镰状细胞贫血每年出生。总成本的人类痛苦和最终无效的医疗保健支出是巨大的。
针对突变
领导的研究人员雅各玉米伯克利分校的家詹妮弗DoudnaCRISPR先驱——引入了创新带来CRISPR治疗镰状细胞贫血靠近诊所。
在他们的描述最新的纸,他们的基本策略是净化不成熟血细胞(之前失去细胞核,红色的正常组成部分血液细胞的发展),正确使用CRISPR突变系统,然后移植细胞回接受者——在这种情况下实验室老鼠。
团队开发了大量的创新。他们首先合成的所有组件CRISPR机械在实验室里,然后组装和交付包裹进入细胞使用电击过程称为“电穿孔”。包裹包含定制的分子工具,削减和替换目标血红蛋白基因的突变。
作者针对性的血液细胞的基因编辑包裹,随后分而产生很多代的血液细胞。这个特性对于长期治疗是至关重要的,因为红细胞迅速磨损他们被注入我们的身体。
利用他们的技术,团队能够成功正确的目标在大约10%的细胞基因突变。这可能听起来不多,但足以对患者有非常现实的临床益处。
在临床中使用有多遥远?
虽然这工作肯定进步CRISPR编辑人类细胞的使用,很多因素限制直接适用性。
首先,本文关注人类血液细胞的校正,被嫁接到实验室的老鼠。虽然相同的细胞可以重新为人类患者,将需要更多的细胞治疗人类,因为人类是比老鼠大得多。
同时,“血祖细胞”的选择目标是有趣的。血祖细胞细胞已经开始开发血液形成的途径。他们不是不朽的干细胞自我更新的在相同的方式,所以纠正血液供应最终会耗尽。
最好是使用实际的血液干细胞细胞更新和维持更长时间,但是这些细胞更少,很难恢复大量的病人。同时,一些研究人员一直在努力实现基因修正血液干细胞,他们想知道这些细胞所需的全部修复途径。
然而,即使纠正血祖细胞可以有效的在合理的时间内,这可能是一个新的治疗如果没有治愈。
道德和政治因素
当考虑这项工作值得注意的是,我们谈论的是纠正血液细胞。这是完全不同的早期的作品由一个单独的团队使用捐赠,不可行的人类胚胎的研究。
以前CRISPR实验集中在使用的基因编辑改变整个身体的基因组,这将是包含在任何后代的卵子或精子如果它来实现。这种基因治疗仍然是极具争议被许多人认为是不道德的,部分原因是它可能会影响未来几代人不能同意治疗。
工作血祖细胞被称为“躯体”基因疗法,因为只有体细胞或改变身体的细胞,这是被广泛接受的。
超出了重要的伦理性考量,实际上这样的昂贵的治疗进入诊所吗?
在美国,是的他们可能。具有较强的医疗投资公司和医疗保险过程成本效益在美国。
在其他发展中国家可能更加困难。因此,许多实验室,包括我自己的——继续努力理解的基本生物学血红蛋白基因。我们的目标是找到负担得起的药物可以治疗疾病,可以在世界各地。