显示用于激活途径的突变基因,导致某些种类的血细胞过量
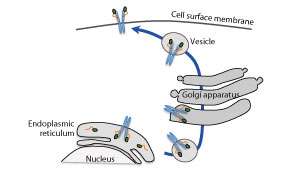
Myeloproiferative肿瘤(MPN)是导致骨髓产生过多的红色或白细胞或血小板的血液癌,导致各种并发症。对于大多数MPN没有已知的固化。
2013年,科学家在被称为CALR的家务基因中的某种形式的MPN和突变之间发现了一种链接,该钙素-A促进蛋白质的折叠的“伴侣分子”。
Ludwig癌症研究所的斯蒂芬康斯坦丁斯柯尔斯比利时研究所称,2013年突破是伴随细胞增殖的致癌活化剂的伴侣源的第一个已知的例子,但这种联系的分子机制是未知的。
“学习如何治疗MPN,我们首先需要了解患病细胞中的细胞信号或存活途径是什么活跃的,”A *星级实验治疗中心的Choong Meng Ling解释说。
由君士宁菌,玲和同官员的研究涉及Calr突变体和激素血栓生成素(MPL / TPor)的受体之间的异常相互作用,其调节驱动一些MPN的过程中的血小板的产生。这项工作涉及与罗伯特克拉洛维主集团的国际合作,在法国Villejuif的维也纳,奥地利和威廉·冯楚克尔的集团。
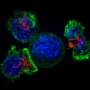
CARR的角色之一是在将其运输到细胞表面之前的血型生成素受体的折叠和处理。研究人员发现,突变体Calrs在细胞和其表面上不正确地将血小板肝癌受体折叠成活性受体。这持续激活JAK2-STAT路径(见图),该团队在某些MPN中激活了该团队。
然后,科学家们使用了一种称为Chou-talalay方法的药物组合研究方法。“这种方法使我们能够用一块石头杀死两只鸟类:它帮助我们同时鉴定突变体含量下游的细胞存活途径和可用于协同衡量这些途径的药物,”Choong说。
该研究具有重要的治疗意义。“JAK2抑制剂,Ruxolitinib是治疗MPN的选择药物,”Choong解释道。但是,但是,由于JAK2是涉及不同功能途径的常见信号分子,但阻止其活性会产生许多副作用。我们发现MEK / ERK抑制剂可以与JAK2抑制剂(Ruxolitinib)协同作用,这将使我们能够实现使用较低量的抑制剂相同的治疗目标,从而减少副作用。“
研究人员打算寻找防止Calr突变体和血小板病害受体之间异常相互作用的方法。“现在我们知道Calr突变体如何影响血小板肝癌受体信号传导,我们可以寻找阻断Calr和血小板生成受体之间相互作用的方法,”Choong Notes Choong。












用户评论