解开神经退行性疾病导致记忆丧失的原因
tau病是一组神经退行性疾病,包括阿尔茨海默病,其特征是脑细胞内tau蛋白聚集物的沉积。一项新的研究表明,一种名为caspase-2的酶切割tau蛋白可能在这些疾病中发生的脑回路功能紊乱中发挥关键作用。有趣的是,在这项研究中发现的罪魁祸首tau片段实际上是抵抗聚集的,并且在脑细胞丢失发生之前,它会在动物模型中引起记忆功能的干扰。
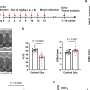
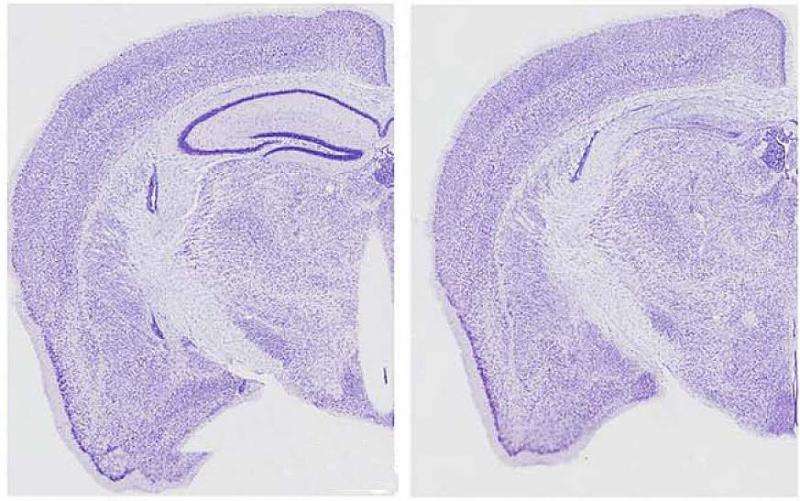
在通过基因工程模拟人类牛头病的小鼠中,研究人员恢复了部分学习和学习能力记忆缺失通过阻断caspase-2活性,这表明在牛头病中看到的一些认知丧失可能是可逆的。这项研究由美国国立卫生研究院下属的国立神经疾病和中风研究所(NINDS)资助,并发表在《柳叶刀》杂志上自然医学.
“这项令人兴奋的研究结果表明,发生在tau病中的认知丧失可以通过阻断caspase-2的功能来逆转,”nninds的项目主管Roderick a . Corriveau博士说。“这促使进一步研究caspase-2作为痴呆症的新治疗靶点。”
利用牛头病小鼠模型产生突变形式的人类τ蛋白在美国,研究人员将记忆缺陷与tau蛋白片段的存在联系起来。当caspase-2在特定位置切割全长tau蛋白时产生的tau片段,与同龄的健康个体相比,在阿尔茨海默病患者的大脑中也发现了更高的水平。
虽然tau病的标准标志是在脑组织中出现大量异常tau蛋白的缠结,但最近不太清楚tau蛋白的缠结是否真的导致认知能力下降。
明尼苏达大学神经学教授、本研究的资深作者卡伦·h·阿什博士说:“在过去,许多研究都集中在神经缠结的积累及其与记忆丧失的联系上,但我们了解得越多,它们似乎就越不可能是疾病症状的原因。”我们已经确定的tau蛋白的病理片段不形成缠结,而是可以在细胞内自由移动。因此,我们决定寻找其他可能影响突触功能的机制。”
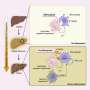
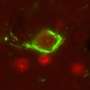
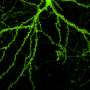
为了做到这一点,阿什博士的团队使用荧光标记来跟踪和比较大鼠海马体培养神经元中正常和突变tau蛋白的行为,海马体是与学习和记忆最相关的大脑区域。与正常的tau蛋白不同,突变的tau蛋白和caspase-2切割tau蛋白时产生的短片段主要存在于树突棘结构中,神经元在树突棘中接收来自邻近细胞的输入。过量的突变tau蛋白,包括caspase-2产生的片段,导致了脊柱突触功能的中断。对突触的影响是特定的,对神经元的整体结构或存活没有观察到的影响。
阿什博士说:“看来,异常处理的tau蛋白破坏了神经元对接收到的信号做出正确反应的能力,产生了独立于纠结形成的记忆缺陷。”“因为这种效应是在没有细胞死亡或突触丢失的情况下发生的,我们有更好的机会干预这一过程,并有望逆转疾病的症状。”