检查点封锁只能帮助一部分病人,为什么?
尽管许多癌症患者对nivolumab和pembrolizumab等免疫疗法反应良好,但大多数患者并非如此。治疗失败的原因通常归咎于所谓的“冷”肿瘤,这些肿瘤不吸引t细胞浸润,可能缺乏关键的t细胞靶点——被称为新抗原的突变蛋白质。
来自芝加哥大学和约翰霍普金斯大学的研究小组在11月7日的《肿瘤与免疫系统反应》杂志上发表了两项相关研究,着眼于参与免疫系统对肿瘤反应的生物标志物美国国家科学院院刊.
突变负荷的作用有限
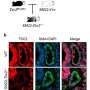
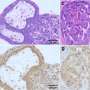
芝加哥大学的研究观察了266个转移性黑素瘤,发现在“热”t细胞炎症肿瘤和“冷”非t细胞炎症肿瘤中发现的新抗原的数量和类型没有差异。该研究提供的证据表明,在非t细胞炎症的肿瘤中缺乏t细胞激活和浸润更有可能是由于无法招募和激活特定的一组肿瘤细胞引起的树突细胞后者处理抗原并将其传递给T细胞。
芝加哥大学病理学和医学教授、该研究的资深作者Thomas Gajewski博士说:“我们发现这些肿瘤充满抗原,但缺乏被称为Batf3 dc的树突细胞子集的证据。”
“这些细胞会引发免疫反应,”他说。“了解这一过程使我们更接近治疗方法,这将扩大抗pd -1药物和其他免疫疗法对患者产生反应的比例。”
“这个模型,”作者写道,“比这个肿瘤子集缺乏抗原识别的假设更能解释现有的数据。”
芝加哥大学高级博士后、该研究的联合主要作者斯蒂芬尼·斯普兰杰博士解释说,这一结果让该领域的人松了一口气。
“人们普遍担心,激活T细胞可能需要一些基线水平的突变负担肿瘤环境,”她说。“如果炎症和突变的存在紧密相关,那么可能引发免疫反应的突变可能不会出现在未炎症的肿瘤中。所以,即使我们把T细胞引诱进来,它们也可能看不到任何好的目标。”
“幸运的是,情况并非如此,”她补充道。“我们发现了大量的良好抗原,在非炎症肿瘤中和在t细胞炎症肿瘤中一样多。现在我们必须设计出更好的方法,让T细胞翻壁进入非炎症肿瘤。”
芝加哥大学医学助理教授、共同第一作者Jason Luke医学博士补充说:“这项研究为理解不同肿瘤类型的T细胞炎症谱奠定了框架,并强调突变密度和新抗原负荷不是驱动检查点免疫治疗反应性的唯一因素。”“随着反应性生物标志物的发展,我们将需要分析单个患者的多种形式的数据,以最大限度地提高治疗效果。”
Gajewski表示,有一些工具可以做到这一点。“我们正在寻找控制各种通路的方法,例如使用STING激动剂或Wnt/ β -catenin通路阻滞剂,这可以限制t细胞对肿瘤环境的浸润。”局部控制限制T细胞进入的信号系统可能具有治疗作用。
国家癌症研究所和Bristol Meyers Squibb资助了这项研究。其他作者还包括鲍日月、查媛媛、Kyle Hernandez、李岩、Alexander Gajewski和Jorge Andrade。
预测生存的五个因素
约翰霍普金斯大学的科学家们研究了癌症基因组图谱中记录的9种癌症类型的3500个肿瘤样本,以分析肿瘤内免疫活动的5种生物标志物。它们包括:肿瘤内的微环境是否发炎,肿瘤细胞中存在的突变数量,以及被称为PD-1、PD-L1和PD-L2的免疫系统相关蛋白质的表达水平,这些蛋白质可以在肿瘤周围的环境中协调表达以抵御免疫系统攻击。
约翰霍普金斯大学医学院皮肤病学和病理学副教授、约翰霍普金斯大学坎摩尔癌症中心及其彭博-坎摩尔癌症免疫治疗研究所成员Janis Taube医学博士说:“科学家们一直在独立地研究这些标志物,但我们想知道它们之间的关系,以及哪些对患者的生存最有影响。”
Taube和她的团队发现,这五个因素在预测转移性黑色素瘤患者的生存期方面都很重要。他们说,其中四个因素——pd -1、PD-L1、PD-L2和炎症——有非常紧密的联系,他们的研究表明,当这些因素的表达水平较高时,在预测患者的生存时,它们比肿瘤中存在的突变量更重要。然而,当这些因素较低时,突变负荷在预测生存中起着重要作用。
Taube说:“这是理解如何开发多因素生物标志物来预测患者预后的重要一步。”
PD-1/PD-L轴表达与黑色素瘤和其他实体瘤的细胞溶解活性、突变负荷和预后的关系PNAS,
www.pnas.org/cgi/doi/10.1073/pnas.1607836113