2017年1月5日报告
研究表明,不同类型的纤维形成与阿尔茨海默病的亚型相关
(欧宝娱乐地址医学Xpress) - 在美国和大学学院在美国大学学院工作的研究人员团队在U.K中发现了似乎脑子和阿尔茨海默氏症亚型的原纤维形成类型之间的相关性。在他们的论文中发表在期刊上自然,该团队描述了他们对已故阿尔茨海默氏症患者大脑的检查,以及他们通过比较淀粉样-肽沉积与进展型的发现。
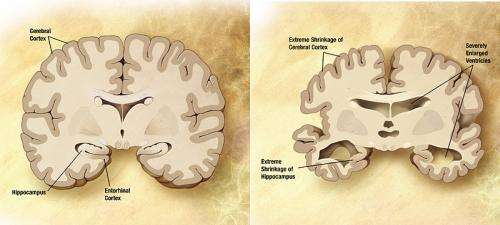
阿尔茨海默病的一个物理标志之一是在脑组织中发育淀粉样蛋白 - β肽沉积物,导致原纤维的产生。现有研究表明,患者的这种原纤维可以在人们之间的形状和大小之间变化,以鉴定亚型的程度。在这一新的努力中,研究人员试图发现某些亚型可能与某些类型的疾病进展相关 - 在这种情况下,迅速进行,后皮质萎缩,这会导致视觉处理的问题。
为了了解更多信息,研究人员从18名死亡的阿尔茨海默氏症患者身上获得了37个大脑样本,其中一些人被诊断出有典型症状,一些人病情进展迅速,一些人有后皮层萎缩,然后将发现的原纤维类型(使用固态核磁共振波谱技术)与三种进展类型进行比较——这是一个非常劳动密集型、长达一年的过程,这就是样本数量低的原因。通过这样做,他们发现有典型症状的患者和那些有后皮层萎缩的患者在他们的大脑中有类似的原纤维形成,而那些快速进展的阿尔茨海默氏症患者的原纤维不仅不同于那些有典型症状的患者,而且也不同于其他同样进展的患者。
研究人员表示,他们的发现表明,纤丝亚型可能与阿尔茨海默病患者的进展类型有关,而且纤丝的形成可能涉及不同的过程。然而,他们指出造成这些差异的机制仍不清楚。他们还表明,随着对阿尔茨海默氏症亚型的了解越来越多,新的定制诊断测试和治疗方法可能会针对特定种类的纤丝形成开发出来,帮助减缓这种仍然无法治愈的疾病的进展病人不管他们的进程类型是什么。
摘要
淀粉样蛋白-β肽聚集成原纤维或其他自组装状态是阿尔茨海默病的发病机制的核心。通过40-和42-残基淀粉样蛋白-β肽(Aβ40和Aβ42)在体外形成的原纤维是多态性的,具有依赖于原纤维生长条件的分子结构的变化。最近的实验表明,体内淀粉样蛋白-β原纤维结构的变化可以与阿尔茨海默病表型的变化相关,类似于与不同临床和病理表型相关的不同朊病毒菌株。在这里,我们研究了在阿尔茨海默病脑皮质提取物中使用Aβ40和Aβ42原纤维对Aβ40和Aβ42原纤维进行的结构变异和Alzheimer疾病表型之间的相关性。我们比较了两种非典型阿尔茨海默病的临床亚型 - 快速逐步的形式(R-AD)和后皮质萎缩变体(PCA-AD) - 典型的延长持续时间(T-AD)。根据来自18个个体的37个皮质组织样本的SSNMR数据,我们发现单个Aβ40纤维结构在来自T-AD和PCA-AD患者的样本中最丰富,而来自R-AD样品的Aβ40原纤维显着表现出显着的更大比例的额外结构。Aβ42原纤维的数据表示来自所有患者类别的大多数样本中的结构异质性,具有至少两个普遍的结构。这些结果证明了在T-AD和PCA-AD中存在特异性主要的Aβ40纤维结构,表明R-AD可以涉及额外的原纤维结构,并表明脑组织中Aβ40和Aβ42聚集体之间存在定性差异阿尔茨海默病患者患者。
©2017医学欧宝娱乐地址快讯











用户评论