研究发现,DNA模式可以解开葡萄糖代谢是如何引发癌症的
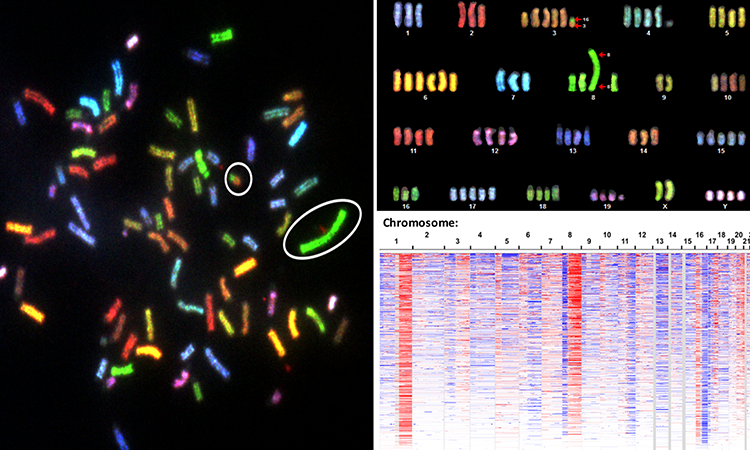
侵袭性较低的癌症已知有一个完整的基因组——细胞中完整的一组基因,而侵袭性较强的癌症的基因组往往有大量的异常。现在,一项新的对肿瘤细胞DNA模式的多年研究表明,这些异常的基因签名不是随机的,而是反映了肿瘤进化过程中的选择性力量。研究结果还表明,这些变化驱动了细胞内的葡萄糖代谢,从而提高了肿瘤的适应度,并可能导致癌症的加速生长。
这项新研究是由资深作者Thomas Graeber博士领导的,他是加州大学洛杉矶分校Jonsson综合癌症中心的癌症纳米技术项目的分子和医学药理学教授。第一作者是USC Viterbi工程学院的化学工程助理教授Nicholas Graham博士和UCLA Crump分子成像研究所的博士后研究员Aspram Minasyan博士。
通过寻找DNA中基因扩增或删除的重复模式,拷贝数改变(CNA)测量被用于描述各种癌症类型的肿瘤。现代研究主要集中于单个癌症基因作为DNA突变和拷贝数变化的主要目标,特别是致癌基因(当突变或扩增时,就像卡住了的油门,可以将健康细胞转变为肿瘤细胞)和抑癌基因(当不能正常工作时,就像坏了或失去了刹车踏板,使细胞生长失控)。然而,科学家继续观察肿瘤中许多复发性CNA模式,这些不能完全用这些典型的癌症基因解释。
人们早就知道两者的根本区别健康的细胞形成肿瘤的细胞是重新编程的细胞代谢。新陈代谢的改变使转化细胞在许多方面受益,尤其是将葡萄糖转化为能量的能力。这一过程被称为糖酵解,可以促进肿瘤生长,也可以通过PET成像检测肿瘤。研究进一步表明,高水平的糖酵解活性与最具侵袭性的癌症之间有很强的相关性。这些发现将这些方面与癌症的破坏基因组联系在一起,通过证明先前无法解释的复发性CNA模式反映了葡萄糖代谢作为许多癌症类型,特别是侵袭性疾病的基因组变化的选择性压力。
在这项为期五年的研究中,格雷伯和他的同事对来自人类肿瘤、癌细胞系和小鼠癌症模型的CNA数据进行了跨癌症分析。研究小组分析了15种不同的样本癌症。他们发现DNA扩增和缺失的CNA模式可以预测糖酵解活性的增加和快速增长肿瘤细胞。为了理解酶如何在这个过程中发挥作用,科学家们比较了人类肿瘤和小鼠模型的CNA模式。他们发现了26个DNA区域有持续的基因改变,包括糖酵解途径中的11种酶以及已知的致癌基因。
接下来,研究人员使用一种实验性的永生系统和基因工程来直接证明糖酵解酶可以影响CNA信号。通过抽样细胞在不同的时间点,研究人员能够展示这些模式如何演变,从而塑造癌症基因组。
该研究是首次使用高分辨率全基因组CNA信号来识别和定义新的肿瘤类别,以进一步补充由致癌基因点突变定义的亚类别。有了这些发现,研究人员可以建立改进癌症建立和发展各种疾病的治疗方法。
“通过关注如此庞大的数据集,而不仅仅是已知的点突变,我们现在更好地理解了联合基因改变的微妙模式是如何影响的葡萄糖代谢“Graeber说,”科学家们表示,“科学家们说,”科学家们现在拥有一个全新的沙箱,我们可以在那里测试和开发将导致对抗这种疾病的人们的新疗法的工具。“
进一步探索










用户评论