该模型有助于解释为什么一些多发性硬化症患者会癫痫发作
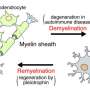
多发性硬化症(MS)是一种中枢神经系统的自身免疫性疾病,全世界有近230万人受到影响。当免疫系统攻击神经纤维周围的保护层,即髓鞘时,就会引发多发性硬化症。随之而来的“脱髓鞘”会损害神经细胞,导致大脑与身体之间以及大脑内部的信息交换受损。
当保护套(最好被想象成电线周围的绝缘材料)被磨损时,神经信号就会减慢或停止。其结果是损害患者的视觉、感觉和肢体的使用,这取决于损伤发生在哪里。永久性瘫痪发生在神经纤维都被疾病摧毁了
这似乎还不够,多发性硬化症患者发病的可能性是正常人的三到六倍癫痫发作——神经细胞异常活跃——与其他人群相比。然而,尽管在多发性硬化症患者中癫痫发作的发生率增加了,但很少有研究来探究它们发生的原因。
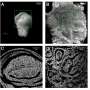
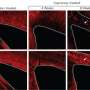
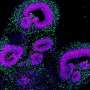
加州大学河滨分校的一组科学家利用小鼠模型首次发现,慢性脱髓鞘与这些癫痫发作密切相关,而且很可能是其原因。该报告发表在神经科学杂志上研究人员还注意到,当大脑皮层和海马体发生大面积脱髓鞘时,大脑中某些被称为“parvalbumin中间神经元”(parvalbumin interneurons)的神经元被修改并丢失,这些神经元对抑制多动症很重要。
他们研究的一张图片刊登在该杂志第346卷(409-422页)的封面上。
“脱髓鞘会对轴突和神经元的损失加州大学河滨分校医学院生物医学科学副教授Seema Tiwari-Woodruff说,他的实验室撰写了这项研究。“这很可能就是那些有癫痫发作的多发性硬化症患者的情况。”
在实验室里,Tiwari-Woodruff和她的团队通过给小鼠喂食含有铜酮的食物来诱导小鼠脱髓鞘,铜酮是一种铜结合物质,会对少突胶质细胞(产生髓磷脂的脑细胞)造成损伤。在给它们喂食铜蛋白酶9周后,大多数小鼠开始癫痫发作。
Tiwari-Woodruff说:“没有髓磷脂,轴突就很脆弱。”“它们会长出球状结构,阻碍重要蛋白质的运输和电信号的传导。在某些情况下,明显的轴突损伤可导致神经元丢失。在MS和我们的小鼠模型中,parvalbumin中间神经元更脆弱,更容易死亡。这导致抑制被移除并诱发癫痫发作。因此,轴突和神经元的存活可能直接与髓鞘提供的营养支持有关。”
在另一项研究中,9或12周后,研究人员停止给小鼠喂食铜酮饮食。少突胶质细胞开始在脱髓鞘区重新生长,并使完整但髓鞘剥离的轴突重新形成髓鞘。未来的研究将评估与脱髓鞘相关的癫痫发作活动。
“脱髓鞘有影响吗癫痫活动?我们能用药物加速脱髓鞘吗?我们是否可以为多发性硬化症患者提供一些缓解?我们有兴趣解决这些问题。”
她的团队最近获得了国家多发性硬化症协会(National Multiple Sclerosis Society)的一项试验拨款,用于比较多发性硬化症患者的死后脑组织,以了解多发性硬化症患者癫痫发作的细胞基础。他们的发现也将用于检查铜酮小鼠模型在人类身上所见变化的复制程度。
Tiwari-Woodruff说:“我们想知道这些组织是否显示了我们在小鼠模型中看到的东西。”“我们对死后组织的初步数据显示,两者之间有很大的相似性。我们现在有一个小鼠模型我们可以用它来测试并提出一些治疗方法。一旦研发出来,这些旨在减少多动症以降低癫痫发作发生率的药物也可以推广到癫痫患者身上。”
进一步探索