Lafora病的潜在原因显示出来
冈山大学的研究人员在期刊上报告,是Lafora病发病机制的潜在第三因素。除了基因突变之外,发现通过亚硝基胁迫诱导的酶Laforin的化学改性也是疾病的可能性。
Lafora病是一种致命的疾病,其特征在于神经元和其他细胞内异常产生的糖蛋白,没有治愈。被分类为A.神经变性障碍它是由基因突变引起的,基因突变影响了人体中两种酶Laforin和Malin的产生。由佐藤Ayano领导的冈山大学研究小组现在已经确定了拉福拉病的另一个潜在原因:当拉福拉素经历一种被称为s -亚硝基化的特殊反应时,这种酶就会停止正常工作。
研究人员推断,由于s -亚硝基化与其他神经退行性疾病如阿尔茨海默氏病和帕金森病的发展有关,这种反应可能也在Laforin病的发病机制中发挥作用。他们首先证实了s -亚硝基化是通过让Laforin与之反应发生的一氧化氮(不)。然后研究了Laforin的s -亚硝基化是否影响其三个生化功能。
Laforin的作用之一是除去由于酶促误差在糖糖中掺入的磷酸盐。这是一个三步过程:Laforin与糖原结合,除去磷酸盐,然后与malin结合。砂光和同事检查了S-亚硝基化的Laforin仍然与糖苷和malin结合;它们的结果表明,改性的Laforin具有与未修饰的Laforin相同的结合能力。Laforin去除磷酸基团的能力 - 其磷酸酶功能 - 是在抑制之后被抑制的
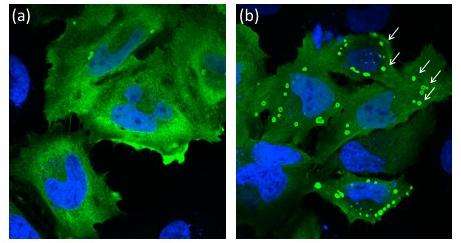
S-nitrosylation。然后作者观察了用NO供体处理表达非突变Laforin的细胞时发生的情况。通过与未处理细胞的比较发现,NO处理后,Laforin细胞形成的Lafora体增加了40%;Lafora小体是Lafora病特有的包涵体,由细胞内积聚的含过多磷酸盐的糖原和沉淀组成。
佐藤和同事的研究结果表明,由于细胞内氧化还原平衡被破坏,no的过量产生导致Laforin磷酸酶活性下降,这可能是一个原因,而不是基因突变,Lafora病。用研究人员的话语:“Lafora疾病表型可以由亚硝化胁迫引起”。需要额外的研究来精确确定Laforin的S-亚硝基化位点,并且进一步的下一步将重复动物细胞或神经元的实验。
Lafora疾病
Lafora病是一种神经变性障碍,如Alzheimer,Parkinson和Huntington的。在Lafora疾病的情况下,无序的细胞代谢导致在各个部分的细胞的细胞质内的不溶性颗粒(称为Lafora体)的积累率人体。症状出现在患者的少年。Lafora病是致命的;患者通常在第一次症状后十年内死亡。
已知的Lafora小体产生的原因是编码两种酶Laforin和Malin的基因突变。后者是所谓的E3泛素连接酶:一种帮助将泛素分子(一种非常常见的调节蛋白)从E2酶(一种能够携带泛素的酶)转移到底物肽的蛋白质。Laforin是一种所谓的葡聚糖磷酸酶:它的功能是从葡聚糖(由大量葡萄糖分子组成的簇)中释放磷酸基。在Lafora疾病的背景下,相关的葡聚糖是糖原(多支葡萄糖分子链组织成球状结构);Lafora体主要由磷酸糖原组成。糖原中磷酸盐的存在使其不溶于水,因此产生拉弗拉体。
佐藤和他的同事推测,不仅突变可以导致拉福拉氏病,而且一种涉及拉福林的化学反应:s -亚硝基化。这个反应对拉福林的修饰达到了这样的程度,它不能再执行它的磷酸释放功能。研究人员发现,Laforin分子确实可以进行s -亚硝基化反应,它们导致表达Laforin的细胞中Lafora体的形成增加。
S-亚硝基化
通过产生特定数量的活性氧(ROS)、活性氮(RNS)和抗氧化系统,细胞能够维持适当代谢功能所必需的氧化还原状态平衡。在过量生产ROS和RNS('亚硝基胁迫')的情况下,可以触发反应,导致细胞代谢的破坏。一氧化氮(NO)是ROS / RNS化合物,可以与Laforin反应;反应称为S-亚硝基化。由于S-亚硝基化被认为是阿尔茨海默氏症和帕金森疾病的发病机制,研究人员提出它也在Laforin病中发挥作用。他们发现S-亚硝基吡咯蛋白失去其磷酸酶功能,因此亚硝化应激可能是Lafora病的另一个原因。














用户评论