研究发现了组织僵硬导致癌症扩散的“甜蜜点”
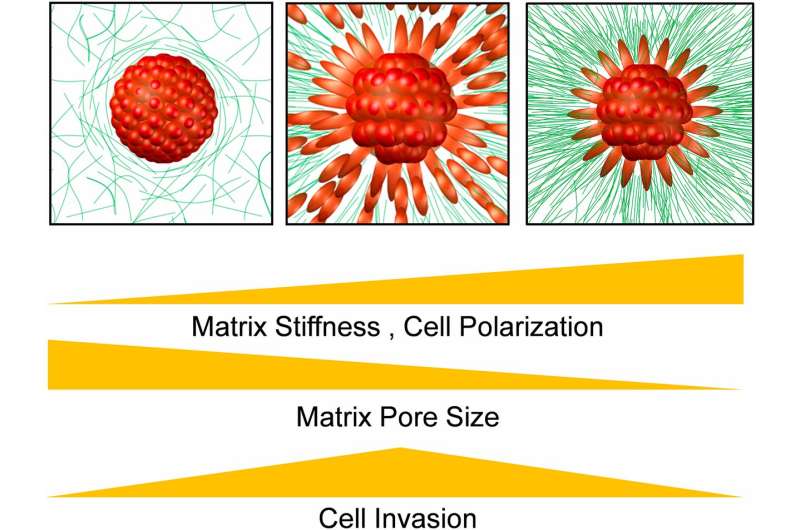
为了对癌症传播,恶性细胞必须脱离肿瘤,并通过细胞外基质的韧性净净化,或者ECM。为了适应该网中的孔,那些癌细胞必须伸长成鱼雷状形状。
宾夕法尼亚大学和Wistar研究所的研究人员现在发现了这些细胞和ECM之间施加的物理力足以推动这种形状变化。这些力会聚在最佳僵硬上,允许癌细胞传播。
研究结果发表在美国国家科学院院刊的研究表明,靶向ECM硬度的药物有可能用于预防转移。
聘请宾夕法尼亚州工程科学与应用科学系教授,博士·艾哈迈德·霍斯·阿赫扎德·霍沙尼副教授,伊拉布里副教授和计划的贡献,他的研究生Wistar肿瘤微环境和转移计划的领导者。
对癌细胞与其环境之间的物理反馈机制的研究是宾夕法尼亚工程学院理解这种动力学的更大努力的一部分,该研究位于物理科学肿瘤中心和新成立的工程机械生物学中心,由谢诺伊共同指导。
Shenoy和他的同事发表的研究结果详细说明了癌细胞及其周围细胞外基质所表现出的反馈机制。在那里,他们展示了这种机制是如何硬化和对齐胶原纤维发现在ECM。新作品看着等式的细胞侧以及细胞必须如何从圆角切换到伸长的内容以便离开瘤通过ECM挤压。
“我们所展示的是,机械因素本身就能导致癌细胞表型的改变,”谢诺伊说。“这是第一次定量分析癌细胞从肿瘤侵入时的形状。”
Penn研究人员假定这种相互作用的关键因素在ECM的刚度中找到了“甜点”。
“肿瘤中的细胞是粘性的,”Shenoy说。“没有ECM的胶原纤维拉动那些细胞,你不能破坏细胞 - 细胞粘附。但是,如果ECM过于僵硬,则基质中的孔变得太窄,细胞不能逃逸。”
宾夕法尼亚大学的研究小组在计算机模拟中模拟了这些相互作用后,威斯塔的Weeraratna实验室进行了匹配实验,看看结果是否成立。
“我们使用胶原基质中嵌入的黑色素瘤球状体作为三维模型,在体外模拟人体内发生的情况肿瘤细胞离开原发肿瘤入侵其他组织,”维拉特纳说。“我们的观察结果与计算机模型完美匹配并互补。这一研究从力学生物学的角度重申了生物膜的关键作用肿瘤微环境在协调命运癌症细胞并对预后和对治疗的反应进行预后和反应。“
来自癌症力学生物学的见解可以为未来的诊断甚至治疗提供信息。
“结论是,如果你观察肿瘤外部的情况,你就可以预测它是否会扩散,”Shenoy说。
进一步探索













用户评论