用钙来控制能量的产生是一个器官特有的事情
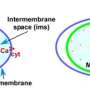
心脏跳动开始于大量的钙进入心脏细胞,随后是来自常驻线粒体的能量爆发。这两个事件发生在每一个节拍。然而这些事件并不局限于心脏细胞,事实上也发生在许多其他器官的细胞中。研究人员提出的一个基本问题是,不同的钙摄入模式是如何与非常不同的能量需求联系在一起的,例如,一个持续跳动的心脏细胞与一个接收到不那么规律的钙信号的肝细胞之间。
现在,托马斯·杰斐逊大学的研究人员发现,线粒体钙通道(调节钙何时以及多少进入的蛋白质)的组成取决于体内的器官,这种差异使得线粒体可以通过解码细胞内钙振荡的振幅和/或频率来调整它们的能量输出。研究结果发表在3月7日的杂志上细胞的报道,有助于我们对器官健康和疾病的基本理解。
“线粒体必须调整能量生产,以满足组织的代谢需要,无论是在心脏,还是在心脏肝或者,“博士”,博士,博士,博士,博士,博士,博士,托马斯·杰斐逊大学和杰斐逊威廉州大学董事,博士,博士,博士,博士,博士,博士,博士,博士,博士,博士,博士,博士,博士,博士,博士,博士豪华,解剖学,解剖学和细胞生物学教授。
Hajnoczky博士和他在mitcare中心的同事Gyorgy Csordas医学博士和Erin Seifert博士研究了三种组织类型小鼠线粒体钙通道的组成:心脏、肝脏和骨骼肌,并注意到被称为MCU的主通道蛋白和被称为MICU1的调节蛋白的比例在不同组织类型中是不同的。他们和其他人先前已经证明MICU1是一个钙感应主开关,它封闭通道直到达到一个阈值,然后加速通道的激活。
令人惊讶的是,研究小组发现,相对于通道蛋白的数量,肝脏中含有大量的调节蛋白,而心脏中调节蛋白的比例较低。这意味着肝细胞有线粒体钙通道,更有可能在调节器的控制下,而心脏细胞有较少的保护线粒体钙通道。
改变门户“保护”或调节水平如何影响线粒体的能量生产?调节蛋白MICU1设定了钙在通道打开之前必须累积的阈值。但MICU1一旦打开,也有助于加速钙通过通道的流动。集团的新研究显示,在心脏细胞线粒体,拥有更少的MICU1监管机构相对于通道蛋白创造机会的高频信号进入线粒体钙和刺激能源生产为了保持持续的心脏的跳动。相比之下,肝脏中较慢的钙振荡服从主开关,从而改善线粒体对每个钙峰值的转移和解码。这也意味着线粒体外的钙需要达到更高的水平才能接近线粒体,也就是说肝线粒体与心脏线粒体相比,与钙响应钙的能量产生,更辨别。
为了测试心脏线粒体是否能像肝脏线粒体一样具有辨别能力,研究人员观察了经过实验处理的小鼠,这些小鼠的心脏细胞中产生了更多的MICU1调节蛋白。结果,心脏变得更弱,有更多心脏衰竭的特征。这表明,心脏中有一个相对不受保护的线粒体钙通道对心脏的正常功能至关重要,这可能是因为这个不受保护的通道允许线粒体吸收足够的钙,以使能量生产与心脏的能量需求相匹配。
“令人责任令人遗憾的是,衰老或失败的心脏是否可能是其中钙的单百蛋白[门耳蛋白]也在失败的心脏,导致其线粒体功能速度速度速度速度,即它无法跟上能量需求,”第一个作者Melanie Paillard,Ph.D.,他们在Hajnoczky博士的实验室完成了研究,目前在法国里昂5队Carmen Langatory,5-CarcioProtection。
有趣的是,在同一组之前发表的一项研究中,当研究人员进行了相反的实验——减少通常具有较高水平的肝细胞中的调节蛋白时,肝细胞变得更多心的地方。开启和产生钙峰值的阈值较低,这意味着肝脏线粒体接触到更多的钙钙比正常。“结果,”Hajnoczky博士说,“肝脏更容易受到损伤,因为线粒体暴露在过多的能量中。”
“这些研究向我们介绍了基本生理学以及这些蛋白质级球员如何参与正常和疾病状态,”Hajnoczky博士说。“未来的工作将进一步探讨这些线粒体蛋白质影响疾病的变化。”






用户评论