新存储器形成过程中钙依赖性激酶的精确机制
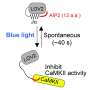
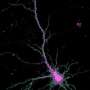
突触塑性是能够加强或削弱神经元之间的突触或通信部位。这些变化是通过在称为树突刺的小神经元突起内的几种不同分子的激活来引发。虽然存在不同形式的脊柱可塑性,但这些明显的形式都是通过常见信号引起的:树突刺的钙的增加。蛋白质Camkii是大脑中最丰富的蛋白激酶,并且特别富集在突触透射,神经递质释放和突触可塑性中起着至关重要的作用。通常,Camkii是无活性的,因为其结合位点被堵塞,但钙除去堵塞,从而激活蛋白质。通过突触通信导致钙浓度飙升,激活Camkii。但是钙尖峰模式转化为Camkii活动仍然是一个神秘的谜。
在2017年5月出版的神经元,来自Ryohei Yasuda实验室的MPFI研究人员描述了他们如何优化现有的成像方法,以更精确地可视化CaMKII激活钙水平增加。通过将荧光寿命成像的时间分辨率提高到毫秒范围,他们首次能够看到CaMKII是如何在突触可塑性中发挥作用的树突棘当钙离子在单个树突中快速连续出现时脊柱。研究人员使用激光脉冲激活单个突触,在小鼠大脑切片的树突棘中激发钙峰值,然后观察CaMKII的活动发生了什么。安田研究小组发现,CaMKII活性随着每一次脉冲的变化而上升,就像钙一样。但是CaMKII峰值比钙峰值持续的时间更长,并且以一种循序渐进的方式组合在一起。因为随着时间的推移,这些信号结合在一起,特定的钙峰值模式可以转化为不同数量的CaMKII活性,从而在突触强度和结构上发生不同的变化。
如果CaMKII蛋白在Thr286位点磷酸化自己,它也可以独立于钙工作。这是因为自磷酸化阻止了CaMKII的结合位点再次被阻断。虽然这是CamKII功能的一个重要特征,但磷酸化如何影响CamKII钙信号的翻译仍是未知的。为了解决这个问题,安田实验室用CaMKII突变体重复了他们的实验,该突变体不能在这个位点磷酸化。突变的CaMKII活性峰值比正常的短,因此,重复突触激活诱导的活性不会随着时间的推移而增加。突触强度和结构的长期变化也受到损害。然而,通过更快地刺激突触,使CaMKII峰值能够叠加在一起,恢复了功能和结构的变化。这些结果表明,通过促进CaMKII介导的钙整合,Thr286的自磷酸化是诱导脊柱可塑性的必要条件,但磷酸化是维持脊柱可塑性的必要条件。
未来发展方向
这是第一个证明钙依赖激酶在单个树突棘突触可塑性诱导过程中的精确过滤机制的报告。本研究的观察结果阐明了Thr286磷酸化在可塑性中的关键作用:它降低了诱导所需的刺激频率突触可塑性并允许CaMKII在生理相关频率整合钙信号。这为长期的推测提供了直接的证据,即Thr286位点的磷酸化与长期记忆有关。
安田实验室的未来研究有望在理解调节记忆形成的分子信号方面取得重大进展。由于CaMKII的功能似乎在精神疾病中受到了干扰,因此利用安田实验室开发的先进成像方法对这种分子进行详细分析,可能为了解大脑疾病(如阿尔茨海默氏病)的发病机制提供重要的见解。








用户评论