揭示帕金森病的新机制

帕金森病是一种令人衰弱的神经系统疾病,影响全世界约有1000万人。它标志着物理功能的渐进下降,最偶联是无法控制的震颤,并且涉及位于大脑中的神经细胞的故障和最终死亡。没有治愈这种疾病,研究人员多年来一直在努力了解其原因。在20世纪90年代,当蛋白质α-突触核蛋白与疾病发育联系起来时,帕金森的研究领域取得了很大的飞跃。这种蛋白质是一种神秘的大脑居民,主要被发现在神经元的末端被称为神经终端。自从被发现的链接被发现是不成功的,试图精确地确定其在帕金森的角色,直到现在。
冲绳岛科技研究生院(OIST)的研究人员发现,这种蛋白质阻碍了神经元信号传输中的一个关键步骤:神经末梢的囊泡内吞作用。神经元信号传输对大脑的高级功能至关重要。这项研究已被批准在神经科学杂志》上。
神经传递是一个让神经元相互传递信号的过程,这些信号对运动、感觉和认知功能都很重要。当电信号到达神经末梢并需要传递到下一个神经元时,包裹在小泡中的神经递质或化学信使介导了这一过程。囊泡是一种由脂膜构成的容器,神经递质从脂膜中释放到突触间隙(神经元之间的空间)。释放后,神经递质被相邻神经元的受体捕获,信号继续传递。与此同时,空泡被循环回到神经末梢再次使用。
空泡膜的回收称为“内吞作用”,过量的α -突触核蛋白破坏的正是这个过程。内吞作用对正常的神经传递至关重要——当它被抑制时,参与神经传递的其他步骤也会受到影响。
“如果你抑制了(神经末梢的内吞作用),那么囊泡的循环就会变慢,囊泡的供应就会受到抑制,”OIST的细胞和分子突触功能单元的Tomoyuki Takahashi教授解释说。“如果你只是温和地使用小泡,这没有问题,但如果你开始大量使用它们,就会出现问题。”
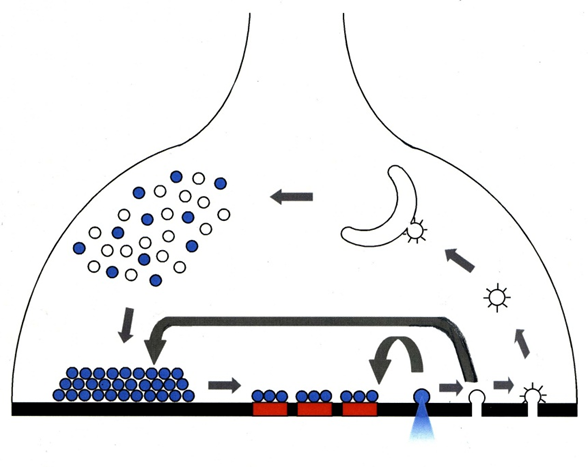
高频传输,其中囊泡大量使用,是重要的过程,如感觉知觉,产生记忆,和运动控制。OIST的研究人员发现,当内吞作用被抑制时,高频传输的中断比正常情况下快得多。
对α -synuclein抑制内吞作用机制的深入研究揭示了微管过度组装的毒性效应。
“微管是一种结构蛋白,”高桥教授解释说。“它就像一根房子的柱子。”显然,阿尔法突触核蛋白太多了神经终末导致微管过度聚集并以某种方式阻止内吞作用。这就像一个房子里有太多的柱子,而且都在错误的地方——你可以想象这样的房子很难住进去,也很难正确导航。
研究人员认为,这种由α -synuclein过量引起的抑制过程发生在帕金森病的早期阶段,在功能丧失和死亡等形态变化之前神经元开始了。
当被问及这些结果是否有助于开发帕金森病的治疗方法时,高桥教授回答说:“我认为我们正在接近成功。我们知道最初的目标和机制…[但是]为了进入[治疗]阶段,我们可能应该多做一些工作,了解微管干预内吞作用的机制。”











用户评论