肌营养的外侧硬化:原因的新线索以及未来的药物可能会逆转疾病
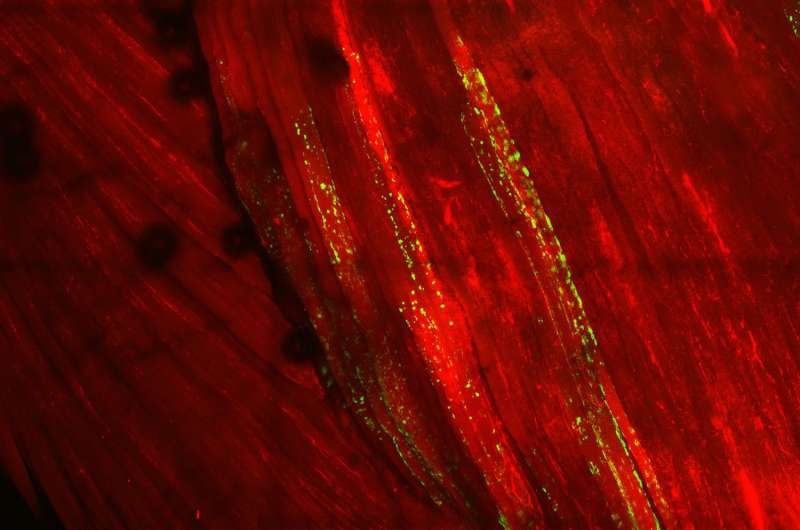
众所周知,科学家们已经知道一种叫做TDP-43丛团的蛋白质在肌营养的外侧硬化症(ALS)的脑细胞中,也称为Lou Gehrig的疾病,并且与神经元死亡有关。据认为,这种相同的蛋白质导致散发性包涵体肌炎(SIBM)患者的肌肉变性,导致许多研究人员认为TDP-43是ALS和SIBM中的致病因素之一。现在,UNC医学和NC国家研究人员发现称为乙酰化的特定化学改性促进了动物中的TDP-43丛生。在小鼠模型中使用天然的防簇方法,科学家们在肌肉细胞中逆转蛋白质丛生,并预防了与肌肉有关的肌肉无力。
发现,发表在自然通信,对理解ALS和SIBM具有重要意义,并为在道路上创造潜在的治疗方法。
“我们怀疑摆脱这种异常的TDP-43丛集可能是这些疾病的潜在治疗,”UNC的神经病学助理教授博士学位。“原则上,我们认为这种丛生的逆转可以通过采取注射或口服药物来实现。但是,我们谨慎,这仍然很长的路。研究社区还有更多的工作要做。”
TDP-43通常在细胞核中工作。它与DNA和从DNA转录的RNA分子结合。这蛋白质似乎有许多重要的功能在调节基因的表达方式方面。不知何故 - 患有SIBM,ALS和一些其他退行性疾病的人 - TDP-43从细胞核中移出并进入细胞的主体积,或细胞质,然后将其团聚在一起。来自细胞核的TDP-43的损失导致正常基因表达调控的失败。许多科学家怀疑这是影响细胞死亡的主要原因。在ALS,电机神经元死亡导致大脑无法控制整个身体的自愿肌肉。在sibm,肌肉变性导致肌肉弱点和强度受损。
多年来,没有人知道TDP-43如何从其正常工作空间中搬出细胞核。在2015年的研究中,Cohen和同事发现了一种可能的因素:称为乙酰化的化学改性。
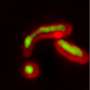
细胞通常使用乙酰化切换蛋白质的活性打开或关闭。2015年,科恩及其同事报告说,TDP-43上的两个斑点的乙酰化导致蛋白质从RNA分离。然后将蛋白质漂浮在细胞质中并开始骨料。该研究是在实验室中生长的细胞中进行的。但要强调与人类疾病的潜在相关性,科学家研究了来自ALS患者的脊柱运动神经元,并确定了以相同方式乙酰化的TDP-43的聚集体。
“这可能是TDP-43的乙酰化通常用作”开关“,控制TDP-43与其靶标和RNA结合的能力,”UNC神经科学中心的成员Cohen说。如果是,则在ALS和其他TDP-43疾病中,正常切换过程如何仍未确定。
对于新的研究,研究人员研究了乙酰化TDP-43在活动物中的作用。在这种情况下,他们寻求模拟小鼠的SIBM,其中肌肉细胞中的TDP-43丛丛。
迈克尔贝尔曼,博士,博士学位博士教授博士教授,州立大学助理教授使用质谱法研究对蛋白质的修饰。
“这对代表0.1%的蛋白质质量的修改非常令人惊讶地可以在基本上启动细胞死亡的过程中具有这种不利影响,”人类健康中心和环境中的环境中心的成员说,Bereman表示。“但这只是强调疾病生物学的复杂程度。对该蛋白质的其他修饰可以以类似的方式起作用。因此,我们必须使用样品制备和质谱中的新技术进行调查这一点。”
“由于基本上相同的TDP-43相关的病理过程 - 丛生效应 - 但在不同的细胞类型中,我倾向于看到SIBM和ALS。”Cohen说。“研究SIBM的优点是肌肉细胞比在ALS中受影响的运动神经元更容易进入。”一旦我们理解TDP-43在SIBM中的作用,我们也可以在神经元中研究这一过程。
他和他的团队使用特殊方法将乙酰化TDP-43蛋白直接注射到小鼠肌肉细胞中。与普通TDP-43蛋白质相反,这些乙酰化蛋白迅速在细胞核外簇生聚集。聚集体重压细胞显示出在人类SIBM中也看到的多种特征。
研究人员观察了表明该细胞标记表明肌细胞正在积极尝试摆脱TDP-43骨料。科恩和他的团队发现,它们可以通过添加热休克因子1(HSF1),以众所周知的蛋白质添加作为反聚集过程的主开关,通过添加热休克因子1(HSF1)来迅速地去除大部分聚集体细胞。
科恩的团队现在希望鉴定适合于具有相同抗簇效应的口腔药物的化合物。Bereman希望为乙酰化和染色体形式的TDP-43形成靶向蛋白质测定,以帮助Cohen的药物筛查努力作为药物效果的衡量标准。
“理想情况下,我们将为某人提供一种促进这些反聚集系统的药物,结果是删除TDP-43骨料和最终恢复肌肉“Cohen说,”Cohen说。“我们希望并怀疑类似的方法也适用于ALS中的神经元。”
进一步探索









用户评论