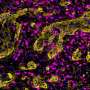
在胰腺癌转移是发现的长期机制
细胞,就像人一样,有记忆。初他们保留分子标记,它们的存在帮助指导他们的发展。细胞发生癌变的可能利用这些早期记忆权力转移的能力,或在体内扩散到其他器官的,新公布的研究显示。
这项研究今天在网上出现细胞提供了强有力的证据支持这个解释的转移,这是大多数癌症死亡的原因。它特别适用于细胞参与的最常见的形式胰腺癌症,被称为胰腺导管腺癌或PDA。
的牵头人,副教授的克里斯托弗•Vakoc冷泉港实验室(3)团队的的证据癌症细胞获取由“记忆”传播的能力发展计划休眠初期以来”意味着每一个细胞,在某种意义上,就像上了膛的枪。”
博士后研究人员进行的实验Jae-Seok Roe和Chang-Il黄,分别Vakoc和Tuveson实验室的3,试图发现仍然模糊机制,使癌细胞转移。他们专注于胰腺细胞,因为几乎所有的胰腺癌转移的超强,可悲的是,过早死亡。只有8%的病人在诊断后5年还活着。
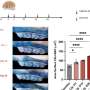
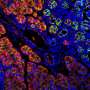
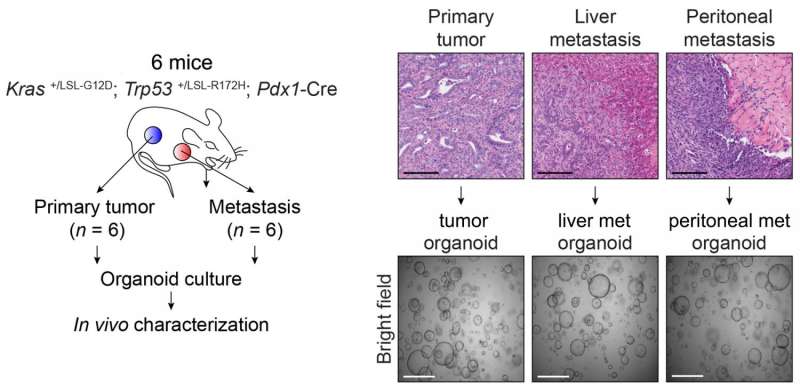
虽然癌症遗传原因很好理解,负责其传播能力的因素有躲避的科学家。Vakoc团队的新结果提出充分理由转移表观遗传根。团队使用胰腺瀑样技术开发实验室的教授大卫•Tuveson 3癌症中心主任和主任研究lustgarte基金会。瀑样使团队比较正常胰腺导管细胞在6小鼠细胞相同的动物在三个不同的阶段:癌变前的,恶性肿瘤,转移性。“重要的是,我们因此比较“苹果苹果,”试图理解至关重要的癌症是如何工作的,“黄博士说。
“肿瘤的形成是由遗传事件,”罗伊博士说,“但其传播的能力可能不涉及直接DNA序列的变化。”This was borne out in their analysis of the pancreatic organoids. Compared with cells in non-cancerous and tumor-derived organoids, those in metastatic ones displayed an extraordinary number of alterations in regions called enhancers. These genome elements are present in all cells, and normally are used by cells to turn on genes. "We show that to metastasize, the cell has to change, in effect, its whole telecommunications network - its enhancers are being reprogrammed," Vakoc says.
团队跟踪活动增加导致重编程的分子代理。称为FOXA1,它通常是活跃在细胞的早期生活,但后来休眠。在癌症,新的研究表明,FOXA1活动使一个细胞回到原始状态——一个胰腺发育形成,细胞增殖和移动,假设描述成熟器官的位置。
“细胞在胰腺转移正在做的事情是要记住什么就像一个胚胎,“Vakoc说。FOXA1激活,诱导增强重组,赋予一个癌细胞转移性属性,是一种表观遗传机制,而不是遗传,这解释了至少一个在这种形式的转移机制胰腺癌,可能其他的癌症类型。
“从我们的结果似乎相当合理的重组增强剂使癌症细胞,一般来说,达到转移能力,”Vakoc说。
更多信息:“增强重组促进胰腺癌转移”在线7月27日,2017年细胞。