抗淀粉样蛋白治疗预防阿尔茨海默病的新前景
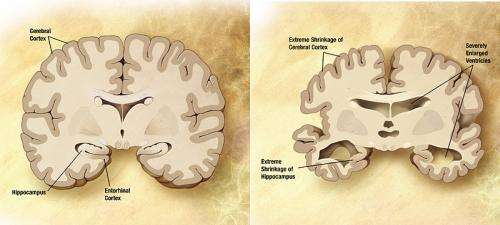
几十年来,研究人员一直在研究阿尔茨海默氏症的潜在基础,为设计一种成功的治疗方法提供线索。本周,VIB/KU Leuven的科学家们在权威杂志上发表了突破性的见解细胞。Lucía Chávez-Gutiérrez教授和Bart De Strooper教授(都是VIB-KU Leuven教授)之间的合作揭示了阿尔茨海默氏病的遗传形式的分子基础,在生命早期发作。这些新发现为设计新的治疗策略来对付这种疾病提供了强有力的见解。阿尔茨海默病的遗传形式是由伽马分泌酶和APP蛋白的突变引起的。γ分泌酶以渐进的方式切割APP数次,每次切割产生一个更短的片段,称为β淀粉样蛋白,释放到大脑中。
VIB-KU Leuven团队发现,伽马分泌酶和APP的致病突变会破坏裂解过程,导致仅部分消化的更长的β淀粉样蛋白片段的产生。这些较长的淀粉样蛋白片段被认为会导致广泛的神经元死亡,导致记忆问题和阿尔茨海默病的其他症状,然后聚集在一起淀粉样斑块(疾病的标志)。研究人员发现,在进展性分裂过程中,致病突变通过削弱伽马分泌酶和APP的相互作用来破坏这一过程。通过这种方式,它们促进了更长的β淀粉样蛋白片段的提前释放。γ分泌酶- app的相互作用被破坏得越多,阿尔茨海默病发展得越快。该报告还表明,细胞环境的改变可以调节伽马分泌酶和APP之间的相互作用,因此也可能影响某人发展为非遗传性阿尔茨海默病的风险。
这些发现对该病的预防和治疗具有重要意义。以前试图解决淀粉样蛋白的毒性作用主要集中在阻止其产生或清除大脑中的淀粉样蛋白斑块。然而,新的见解表明,稳定Gamma分泌酶和APP之间的相互作用可能足以避免释放更长的有毒物质淀粉样蛋白通过这种方式预防或延缓疾病。Lucía Chávez-Gutiérrez教授(VIB-KU Leuven):“导致家族性老年痴呆症的突变疾病显示了加强Gamma分泌酶和APP之间相互作用的药物的临床相关性。复合物越稳定,APP可以进一步加工,产生更短的、无毒的形式β淀粉样蛋白。"
进一步探索










用户评论