基因检测的新方法导致MET融合肺癌的显著反应

有很多方法可以改变基因,并且存在许多基因,当改变时,会导致癌症。对于每种癌症相关基因的每个可能的改变进行单独进行测试,因为它需要数百个单独的测试和许多数千美元,这是不可行的。科罗拉多大学癌症中心案例研究今天发表于期刊JCO精密肿瘤学强调了另一种选择:使用可以同时在许多基因中寻找基因改变的测试。该技术在首次发表的报告中描述了在肺癌患者中成功靶向MET融合。
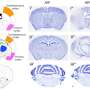
在这项研究中,研究人员检查了晚期肿瘤样本肺癌病人使用检测方法基因融合在几十个基因。该测试发现了一种罕见的涉及MET基因的融合,这促使研究人员使用抑制MET信号(以及其他类型的信号)的靶向疗法克里唑替尼治疗癌症。现在,在开始靶向治疗8个多月后,这名被诊断为IV期肺癌的患者继续显示出几乎完全的应答。
“我们接近阶段阶段的工作和治疗方式肺癌患者包括广泛的分子分析,所以这就是我们所做的,“患者的肿瘤科学家,临床和翻译研究中的临床和翻译研究中的高级研究员表示,在Cu癌症中心和Cu医学院的临床和翻译研究中。
在用于这种分子图谱的测试中,有一种相对较新的检测方法,叫做Archer FusionPlex,由博尔德的生物技术公司ArcherDX开发,并由科罗拉多分子相关实验室(CMOCO)进行临床验证。一个先进的分子诊断实验室,是科罗拉多大学病理科的一部分。该检测不是检测单个基因的改变——例如,分别检测已知致癌基因ALK、ROS1或EGFR的改变——而是探索了整个一类的基因变化,同时检测53个癌症相关基因的“基因融合”。
在这些基因融合中,一个基因的片段偶然地与另一个基因的片段相连。这就产生了“嵌合蛋白质”——由每一部分组成的新蛋白质——可以促进癌症的生长。在肺癌中有两个明确的例子是涉及ALK和ROS1基因的融合。MET基因也被认为是导致癌症融合的伙伴,事实上,MET基因的其他变化包括MET的突变,MET的扩增,以及一种被称为外显子-14跳跃式突变的东西已经被肺癌临床试验中的研究药物锁定。然而,MET融合的检测并不常见。
“肺癌患者的频率远低于1%。您永远不会单独测试它们。您需要一个看起来同时看待许多事情来捕获这些罕见的事件的测定,”博士说,博士说测定发展科学家CMOCO。
添加到挑战是识别MET融合基因不仅需要测试满足,而且以非常具体的方式测试。
“很多测试表明,它们涵盖了MET,但这并不意味着它们发现了这种特殊的变化。Robert C. Doebele博士说,他是加州大学癌症中心的研究员,也是加州大学医学院医学肿瘤学副教授。
2016年,来自州的患者计划在丹佛拜访她的女儿。她以前被诊断出患有肺癌,并知道在科罗拉多州,她需要从当地治疗团队中保重。
当她来到科罗拉多大学医院时,“我们可以看到她的肿瘤生长,”Ng说。
Cu Cancer Cent的团队要求在早期手术中被移除的患者肿瘤样本,并使用该样品进行分子测试。
“在CU,除了大多数社区中心会使用的测试,寻找像EGFR, PD-L1, ALK和ROS1,我们做了一个更广泛的小组。我们寻找KRAS、MET扩增、MET第14外显子跳跃突变、RET基因重排、BRAF-V600突变、HER2突变等。所有这些都是负面的。但我们做的另一件事是基于rna的下一代测序分析,叫做FusionPlex。这个NGS平台在53个癌症相关基因中寻找基因融合。这项实验的独特之处在于,你不需要知道一个基因的融合伴侣就能确定是否存在基因融合。”
这就是该团队如何识别患者的MET融合。下一步是决定如何治疗。
“很多人不知道药物crizotinib最初被设计为一种抑制剂的基因产物,”戴维斯说,他指出,该药物的第一个FDA的批准是不反对了但对ALK-positive肺癌和最近批准治疗ROS1-positive肺癌。“但现实是,这类药物中的大多数都达到了许多目标。有时这是有害的——它会击中你不想击中的东西。这是一个有益的例子。”
在本例患者中,克里唑替尼靶向MET的策略显示了显著的效果。
“她的第一次扫描表现出几乎完全的回应,完全没有肺结节”,Ng说。副作用包括疲劳加剧,“但总体上没有危及生命或阻止她继续服药的副作用,”Ng说。
据Doebele说,这项研究有两方面的意义。首先,“这项研究显示了广泛的分子检测的重要性,也显示了商业实验室对其覆盖的内容提高透明度的重要性,”他说。第二,“这个病例报告和另一个描述在胶质母细胞瘤中使用克唑替尼与MET易位的报告表明,这是一种合理的非fda批准的治疗这些患者的方法。然而,这种方法还需要在临床试验中进行研究,我们希望这个案例表明MET易位应该包括在评估MET抑制剂疗效的药物试验中。”
至于那位病人,吴恩达说:“前几天她来看我们,她告诉我,能来科罗拉多看我们,她感到很幸运。否则,她永远也不会发现癌症的致命弱点。”
进一步探索










用户评论