FDA批准个性化先进细胞治疗白血病
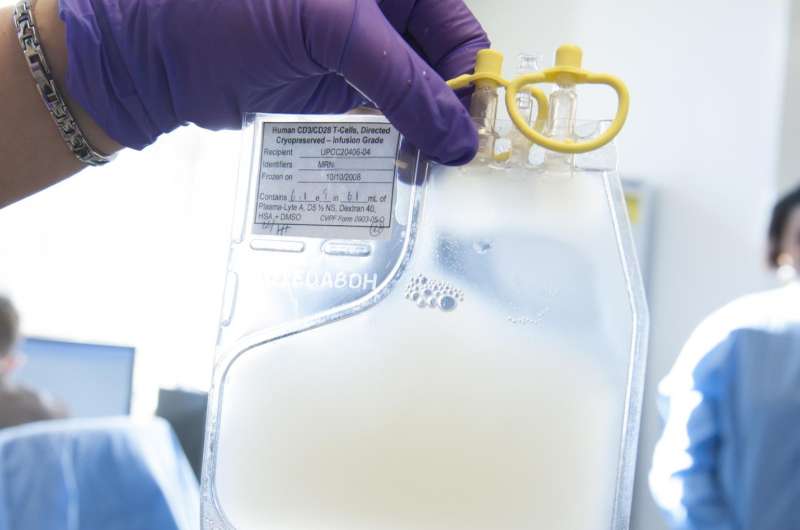
在癌症免疫治疗领域的一个里程碑式的决定,美国食品和药物管理局(FDA)今天批准了一项个性化细胞治疗由宾夕法尼亚大学和费城儿童医院(切)治疗患者25岁b细胞前体急性淋巴细胞白血病(ALL)耐火材料或晚些时候在第二或复发。批准授予诺华的嵌合抗原受体(汽车)t细胞疗法,Kymriah™(tisagenlecleucel,以前CTL019)。2012年,宾夕法尼亚大学和诺华进入了一个全球合作进一步的研究,开发和商业化Kymriah和其他CAR-T细胞疗法治疗癌症。Kymriah是第一个治疗基于基因转移得到FDA的批准。
调查员宾夕法尼亚大学佩雷尔曼医学院的,切,谁一起领导研究、开发、和临床试验的新疗法与诺华公司合作,将FDA批准誉为改变游戏规则治疗年轻患者对抗激进的血液癌症,在这个新时代的一个关键里程碑细胞疗法治疗癌症患者自身的免疫系统。
“这是一个转折点在对抗b细胞,开辟了世界各地的机会病人迫切需要新的选择,”卡尔说6月,医学博士,教授理查德·w·模糊免疫疗法的病理学和实验室医学系在宾夕法尼亚大学佩雷尔曼医学院和中心主任艾布拉姆森癌症中心的细胞免疫疗法。
“我们很高兴和自豪,这车疗法,与诺华和切合作,通过开发的所有阶段和临床试验,建立了它的功效,现在全国的孩子们在这种打击范围扩大食品及药物管理局的批准,”他补充道。“我们希望技术背后的动力建立在我们继续研究个性化的能力在血液癌症和实体肿瘤细胞疗法帮助许多其他类型的癌症患者。”
Kymriah有望通过网络注册在美国治疗中心。
“我们交付工程t细胞疗法在世界上第一儿科病人砍,艾米丽·怀特海德,他只有六岁的时候她对常规治疗白血病停止反应。艾米丽的癌症仍在缓解,在较大的试验中,我们看到总缓解率超过80%,这是在以前的治疗成功率显著改进,”首席研究员说砍和全球临床试验的治疗,斯蒂芬Grupp,医学博士,博士的耶特掀起Novotny儿科教授潘和癌症免疫疗法前沿项目主任和首席的节细胞疗法和移植。ob体育开户网址
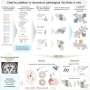
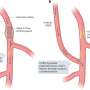
新的治疗修改病人的免疫T细胞,收集和重新编程的诺华制药生产设施可能寻求并摧毁患者白血病细胞。注入后回到病人的身体,这些新建的“猎人”细胞繁殖和攻击,针对细胞表达一种叫做CD19的蛋白质。测试表明,猎人细胞的军队可以长到超过10000新细胞为每一个工程细胞患者接受,生产完全难治性白血病缓解率高,在体内能存活多年。
“这转换治疗病人是真正的行业之间的协作的结果,学术界,医疗专业人员,病人和照顾者“布鲁诺Strigini说,首席执行官,诺华肿瘤。“我们感谢所有那些参与这一历史性的食品及药物管理局的批准,它提供了新的希望孩子和年轻的成年人有有限的治疗方案。”
CTL019最早在2010年测试了宾夕法尼亚大学,成人患者的慢性淋巴细胞白血病(CLL)。2012年,切成为第一个机构调查Kymriah儿科患者,最常见的儿童癌症。大约20%的每年有3500儿童和年轻成人患者中诊断与所有在美国复发或不应对常规治疗。
这些早期的临床试验中,超过90%的患者达到完全缓解后一个月接收治疗,导致了2015年全球注册试验,涉及68名儿童和年轻人与先进治疗25中心在世界各地。百分之八十三的病人接受单剂量的工程细胞达到完全缓解。
2017年7月,美国食品药品监督管理局的顾问团一致推荐批准的疗法,对于今天的FDA批准铺平了道路。后的试验数据和证词来自家庭的孩子接受了治疗,一个专家小组说这是“最令人兴奋的事情在我的有生之年我看过。”
许多患者在所有试验经验称为细胞因子释放综合征(CRS)的副作用包括3级或4级,包括不同程度的流感样症状,高发烧,恶心,和肌肉疼痛,和暂时的神经症状,还包括精神错乱,但低血压和呼吸困难在最严重的情况下需要ICU-level保健。百分之十八的病人经历过3级或4级神经活动。患者接受免疫抑制剂药物叫或类固醇可以对抗短期课程。
诺华将创建一个注册中心遵循病人在接受治疗后15年监控他们的进展和任何潜在的未来的副作用。
其他试验CTL019治疗也进行艾布拉姆森癌症中心的成人患者和患有慢性淋巴细胞白血病和非霍奇金淋巴瘤。佩恩和诺华也在研究治疗多发性骨髓瘤的下一代汽车,实体肿瘤,通过试验胶质母细胞瘤、间皮瘤、卵巢癌、胰腺癌。宾夕法尼亚大学正在探索其他汽车试验技术对前列腺癌、黑色素瘤、三阴性乳腺癌。
Novartis-Penn先进细胞治疗中心(CACT作业者)于2016年开业,举办了美国副总统拜登(Joe Biden)在他的癌症月球探测器的发射计划,巩固佩恩的角色作为一个国际创新者开发和制造的个性化细胞疗法。