哪些在小鼠身上的研究结果将帮助患有多发性硬化症的人类?现在有一种方法来判断
 CC BY-SA 3.0 Marvin 101/Wikipedia" width="500" height="371">
CC BY-SA 3.0 Marvin 101/Wikipedia" width="500" height="371">
患有多发性硬化症(MS)的人再清楚不过了,当听说在老鼠身上成功治疗这种疾病对人类几乎没有效果时,他们有多沮丧。
不幸的是,由于没有针对多发性硬化症的大型动物模型,在小鼠身上有希望的新疗法的结果往往在人类身上无效。
现在,布法罗大学的研究人员已经开发并成功测试了一种方法,以确定从小鼠模型中发现的人类疾病的相关性。这项研究发表于8月8日干细胞报告.
“这是该领域的一个重要资源,因为它允许我们比较人类和啮齿动物的细胞,并提供了一个参考点,以了解基因表达模式是否在物种之间是保守的,”弗雷泽·西姆博士说,他是布法罗大学雅各布医学和生物医学学院药理学和毒理学的高级作者和副教授。共同第一作者是Suyog U. Pol博士,现在是博士后,和Jessie J. Polanco,博士候选人,都在医学院。
MS试验失败
Sim说:“当有希望的观察结果从小动物模型转化为临床时,临床试验有太多的失败。”“我们的主要动机是试图在分子水平上了解负责合成髓磷脂的人类细胞与研究得更好的小鼠细胞有何不同。”
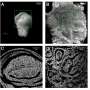
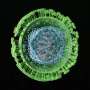
多发性硬化症和其他一些神经系统疾病发生在髓磷脂损伤时,髓磷脂是一种允许神经细胞交流的脂肪鞘。因此,在大脑和脊髓中发现的产生髓磷脂的细胞,即人类少突胶质细胞祖细胞(OPCs),一直是更好地了解多发性硬化症和开发潜在的新治疗方法的主要焦点。
Sim解释说,在MS患者的脑病变中经常发现未分化的OPCs,因此促进这些细胞的分化可以导致髓鞘形成和症状减轻。
从OPCs到少突胶质细胞
这就是为什么这么多人临床试验失败可能是因为类型和水平的根本差异基因在小鼠和人类之间表达。Sim和他的同事通过对区分人类OPCs进行基因表达分析来解决这个问题。
Sim说:“在这篇论文中,我们描述了人类OPCs如何发展成少突胶质细胞的转录事件。”
为此,他们使用了一种名为加权基因共表达网络分析(WCGNA)的网络分析软件工具。该软件将具有相似表达模式的基因聚集在一起。它还允许分析人类和啮齿动物之间的保守和发散的基因表达。
Sim说:“WCGNA研究的是基因之间的关系,而不是任何给定实验中条件之间的绝对差异。”
他补充说,编码在基因表达水平增加或减少的信息是非常可靠和可复制的。
“我们以完全相同的方式对从小鼠、大鼠和人类分离的细胞进行了WCGNA,并制备了这些细胞细胞在尽可能接近匹配的条件下,试图保持事物尽可能相似,以促进这种比较,”Sim说。
结果发现,该团队发现的与人类疾病相关的几个基因也与小鼠的发育和髓磷脂疾病的小鼠模型有关。
新的髓磷脂修复基因
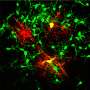
根据分析的结果,该团队预测GNB4,一种参与信号转导的蛋白质,将参与人类OPCs的发展。研究人员发现,GNB4是一种参与细胞外信号转导的蛋白质,当移植到MS的人类细胞治疗模型时,GNB4的过度生产可能导致人类OPCs迅速发生髓鞘化。
“所以这种蛋白质的表达少突胶质细胞祖细胞可能最终成为一个治疗靶点,潜在地促进MS患者少突胶质细胞的形成,”Sim说。
该方法还确定了其他几个重要的候选蛋白,它们在调节人类少突胶质细胞的发育中发挥关键作用。
进一步探索