科学家揭示了溶酶体转运在阿尔茨海默病进展中的作用
耶鲁大学医学院的研究人员发现,神经元内溶酶体运输的缺陷会促进阿尔茨海默病小鼠大脑中蛋白质聚集物的积聚。这项研究将于8月7日发表在细胞生物学杂志(JCB)的研究表明,开发恢复溶酶体运输的方法可能是治疗神经退行性疾病的一种新的治疗方法。
阿尔茨海默病是美国第六大死亡原因,目前估计有超过500万美国人患有这种疾病。这种疾病的一个特点是形成淀粉样斑块在大脑内部。斑块由一种叫做β-淀粉样蛋白的有毒蛋白质片段的细胞外聚集物组成,周围环绕着大量肿胀的轴突神经元传导电脉冲到其他神经细胞。
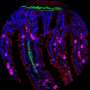
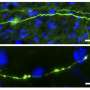
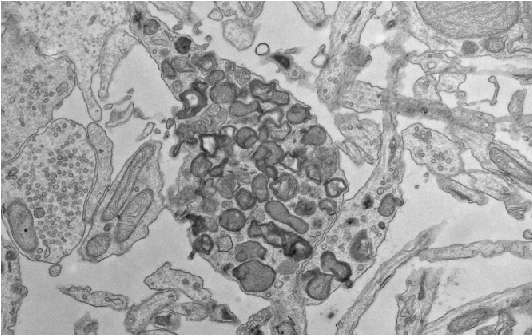
这些轴突肿物充满了溶酶体,溶酶体是细胞垃圾处理单元,可以降解细胞中旧的或受损的成分。在神经元中,溶酶体被认为是“成熟”的,因为它们从轴突的末端被运送到神经元细胞体,逐渐获得了降解它们的货物的能力。与淀粉样斑块相关的轴突肿胀内的溶酶体无法正常成熟,但这些溶酶体如何促进阿尔茨海默病的发展尚不清楚。一种可能是它们促进了β-淀粉样蛋白的形成,因为一些酶通过裂解一种叫做淀粉样前体蛋白(APP)与未成熟溶酶体一起积聚在肿物中。
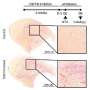
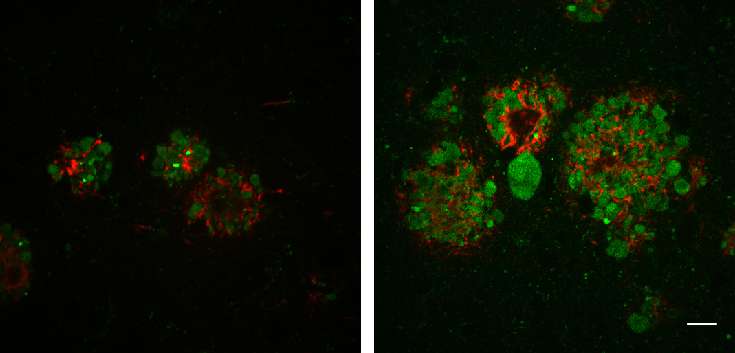
耶鲁大学医学院的Shawn Ferguson和他的同事通过阻碍小鼠神经元中溶酶体的运输来研究这种可能性。研究人员发现,缺乏一种名为JIP3的蛋白质的神经元无法将溶酶体从轴突运输到细胞体,导致溶酶体在轴突肿胀中积累,这与阿尔茨海默病患者中看到的情况类似。肿胀也会积累APP和两种酶——BACE1和早老素2——将APP裂解产生β-淀粉样蛋白。因此,缺乏JIP3的神经元产生了大量的β-淀粉样蛋白。
然后,研究人员删除了编码JIP3的基因的一个副本,将JIP3的数量减少了一半蛋白质——来自那些已经容易患上阿尔茨海默病的老鼠。这些动物产生了更多的β-淀粉样蛋白,形成了更大的淀粉样斑块,周围有更多肿胀的轴突。
Ferguson说:“总的来说,我们的研究结果表明,淀粉样斑块上溶酶体的轴突聚集并不是无辜的旁观者,而是APP处理和淀粉样斑块生长的重要贡献者。”
因此,阻碍溶酶体转运的遗传和环境因素可能会导致阿尔茨海默病的进展。例如,创伤性脑损伤被认为是阿尔茨海默病的重要风险因素,是已知的破坏沿轴突的运输并引起轴突肿胀。
“确定了其他与JIP3一起在调节轴突运输溶酶体的成熟可能最终导致调节溶酶体轴突丰度的策略,以达到治疗目的,”弗格森说。
进一步探索