炎症神经障碍产生的新型干细胞衍生模型
由加州大学圣地亚哥医学研究人员领导的国际科学家队创造了一种罕见但毁灭性,遗传性神经系统自身免疫病症的人类干细胞基础型,称为AICARDI-GTIERES综合征(AGS)。在这样做时,该团队能够识别不寻常和令人惊讶的基础遗传机制,这些机制驱动AGS和测试策略以抑制使用现有药物的病症。
两种重复的FDA批准的药物显示可测量的效果,从AGS的影响中救出细胞。结果指出了未来临床试验的承诺,以及在没有其他型号的其他型号可用时创建新的干细胞的人类疾病模型的效用。
调查结果发表于8月10日在线问题细胞干细胞。
“我们的方法现在可以用于研究其他神经病症,如自闭症和精神分裂症和重叠的自身免疫疾病,即类似方式功能障碍的功能障碍,”博士学位的儿科和细胞和分子的教授ob体育开户网址医学,UC San Diego Stem Cell计划主任和桑福德联盟的成员进行再生医学。
首先在1984年描述,AGS通常涉及影响脑,免疫系统和皮肤的早期发炎。其严重程度取决于哪些基因涉及哪些基因 - 有六种类型 - 但通常会导致微微术(异常小的头部)和皮肤和视力问题和关节刚度的明显生理和心理后果,并在第一年出现生活。综合症是较前的,导致幼儿期内的死亡或持续植物州。目前,没有治愈;唯一的治疗方法是对症或姑息性的。
AGS的临床特征模仿获得的病毒感染在子宫内在出生前,随着炎症标志物的水平增加和炎症反应的其他签名。然而,Muotri表示,AGS和外部病原体之间没有联系。以前的研究表明,AGS患者在对细胞免疫反应调节中对核酸代谢的基因突变,其中包括一种称为TREX1的酶的缺乏,这有助于防止异常DNA积聚在细胞中。
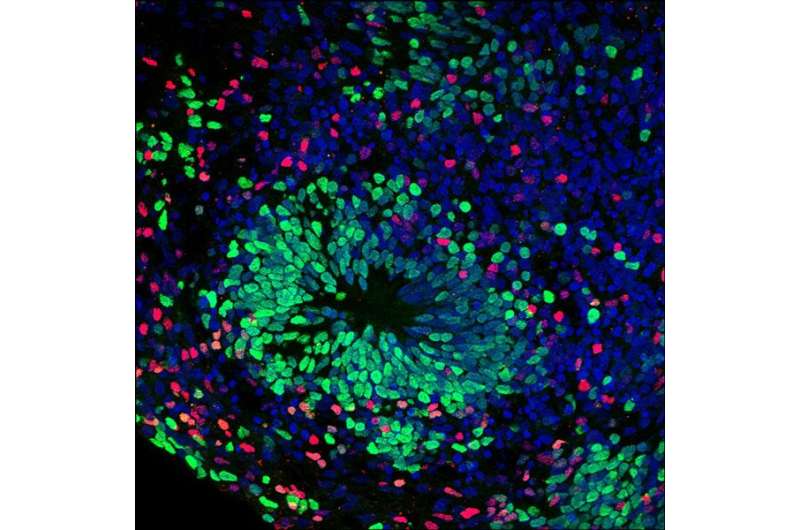
更深入的探讨了AGS的发病机制是困难的,因为动物模型不能准确地模仿人类的疾病。如此muotri,与同事一起使用胚胎干细胞并诱导多能干细胞(IPSCS)来自AGS患者的六种细胞模型的病情。在过去,Muotri的实验室已经开发出类似的“疾病 - 内啡会”神经元模型,厌食症,厌食症和威廉姆斯综合征,以及其他罕见的遗传神经系统。
从IPSCS,它们也创造了脑有机体或“迷你大脑” - 将自己组织成皮质结构的神经元簇,类似于显影人体脑皮质。
研究人员发现,对于不正常运作的TREX1,所有细胞模型都显示出多余的染色体DNA,并且过量DNA的主要来源来自Line1(L1)逆机。L1S是DNA的重复序列,具有在人类基因组内自主复制和糊剂的能力。在过去,他们被称为“跳跃基因”,因为它们在细胞内的功能很大程度上是未知的“垃圾DNA”。
然而,术语“垃圾DNA”越来越变得误解。例如,在2005年发布的工作中,Muotri和同事报告说,与其他组织相比,L1S对脑细胞产生高影响,这表明如果是迄今为止的脑部发育中的作用,那么重要的话。
从那时起,他说,世界各地的研究人员已经调查了L1s在大脑中创造遗传马赛中的作用。“这些是古老的基因组寄生虫,其在我们的细胞内复制。目前的大部分工作都集中在这种基因组镶嵌的影响,但我们决定在核外面看。以及我们发现的是一个大惊喜。”
在研究人员创建的一些AGS细胞模型中,从过量的DNA中建立了毒素。其他表现出异常的免疫应答,分泌诱导的毒素细胞死亡在其他细胞中。有机体中的综合效果在发生相反的情况下是神经元生长的大规模降低。“这些模型似乎在开发的胎儿中反映了AGS的发展和进展,”Muotri说。“当神经发展应该升高时,它是细胞死亡和减少。”
通过核外部的L1分子的抗病毒反应延伸细胞死亡。“我们发现了一种新颖和基本的机制,慢性反应L1元素可以对人类神经发育产生负面影响,”Muotri实验室的前一名研究生和第一个作者的研究生托马斯表示。“这种机制似乎是人类的。我们在鼠标中没有看到这一点。”
研究人员观察到,AGS发病机制与逆转录病毒感染类似,并想知道现有的HIV抗逆转录病毒药物是否有效干扰L1复制。在细胞模型中测试了两种药物:Stavudine和Lamivudine。两种药物导致L1减少和细胞毒性。细胞模型所有细胞类型和络合物中返回的生长,并在包含有机体的神经细胞的分化菌落中。
Muotri说,数据支持艾滋病毒药物可以使艾滋病毒药物能够使AGS患者受益。由Store Co-Author Yanick Crow,MRCP,Phd,Sorbonne Paris Cite University和曼彻斯特大学的临床试验已经开始在欧洲。
Muotri表示,调查结果正在照亮和令人鼓舞,提供平台和推动,以进一步研究神经炎症和药物发现的病理学。“重要的是要注意,这项工作的重点是AGS,神经细胞在精神分裂症中,展示了L1元素的过多 - 与其他自身免疫障碍的重叠重叠。
“这是如何将基本基础研究迅速翻译成诊所的一个很好的例子。这些不同疾病中的工作有类似的机制吗?这种建模策略是否有关更好的理解和治疗它们?这些是我们现在追求的问题。“
进一步探索









用户评论