研究人员描述了与年龄相关骨质流失基础的机制

老年人的一个主要健康问题是与年龄相关的骨质疏松症 - 骨骼的稀疏和骨密度的损失,增加了骨折的风险。通常,这伴随着骨髓中脂肪细胞的增加。
阿拉巴马大学伯明翰研究人员现在详细介绍了导致骨质疏松症的潜在机制。当这种机制故障时,祖细胞停止创建骨- 生产细胞,而是创建脂肪细胞。对这种机制的了解可以提供目标,以寻找新型的骨减脂疗法,以治疗人类骨质疏松症的副作用最少。
UAB研究人员发现,一种称为CBF-β的蛋白质在维持产生骨骼的细胞中起着至关重要的作用。此外,对老年小鼠的检查显示出大幅度降低的CBF-beta水平骨髓细胞,与年轻小鼠相比。
因此,他们提出,维持CBF-β可能是防止与脂肪细胞升高的人类相关骨质疏松症至关重要的。
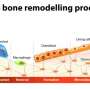
骨骼是一种不断重建的活组织。骨骼需要持续的新细胞创建特定于组织的细胞,包括产生骨细胞的骨骼生产细胞。成骨细胞仅活三个月,不会分裂。
成骨细胞的祖细胞是骨髓间充质干细胞。除成骨细胞外,间充质干细胞还可以分化成可产生软骨的软骨细胞,有助于形成肌肉和脂肪细胞或脂肪细胞的心肌细胞。因此,同一祖细胞具有四个可能的分化轨道。
UAB研究人员和同事的重点是控制成骨细胞和脂肪细胞轨迹之间的谱系承诺切换的分子机制。在UAB病理学教授和UAB病理学副教授的UAB病理学教授和M.D. Wei Chen的领导下,他们研究了CBF-Beta或核心结合因子亚基β的关键作用。
研究细节
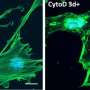
由Li和Chen领导的团队通过在成骨细胞谱系的各个阶段删除CBF-BETA来产生三个鼠标模型。所有三种小鼠模型均显示出严重的骨质疏松症脂肪细胞在骨髓中,这种病理类似于增强脂肪细胞的衰老骨骼。
骨髓间充质干细胞和骨细胞从CBF-β缺陷型小鼠的头骨中显示出脂肪细胞基因的表达增加。
从下游的机制来看,研究人员发现,CBF-beta的损失阻碍了规范的Wnt信号通路,尤其是通过降低WNT10B表达。在非膨胀小鼠中,他们发现由CBF-beta和Runx2转录因子组成的蛋白质复合物与Wnt10b启动子结合以驱动WNT10B表达。CBF-beta/runx2复合物还抑制了促进脂肪细胞分化的增强子蛋白C/EBP-α的表达。
此外,研究人员表明,CBF-beta通过两种方式维持成骨细胞谱系的承诺 - 通过Wnt旁分泌途径来影响附近的细胞并通过细胞内的内源信号传导抑制脂肪形成基因表达。
总而言之,对CBF-beta驱动的机制的这种知识可以帮助解释老年人看到的骨骼维持的不平衡。
进一步探索







用户评论