线粒体转移抑制通路控制肿瘤细胞代谢重编程
Wistar Institute的研究人员通过研究人员鉴定了蛋白质术语蛋白综合差素或SNPH的一种新型蛋白质Syntaphilin或SNPH的蛋白质嗜吡辛和肿瘤和营养短缺之间的选择。本研究描述了一种新型转移抑制途径,并发表于此临床研究杂志。
“转移性疾病是癌症患者死亡的主要原因。我们在有针对性的癌症疗法中做出了巨大的进展,但我们仍然面临着耐药性的挑战,我们对转移传播机制的了解并不是那么深,”said lead author of the study Dario C. Altieri, M.D., president and CEO of The Wistar Institute, director of The Wistar Institute Cancer Center, and the Robert & Penny Fox Distinguished Professor. "Our findings contribute much-needed information on tumor plasticity leading to metastatic dissemination, and may lead to new therapeutic aproaches."
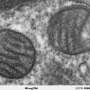
肿瘤细胞必须能够适应不利的环境条件,包括低氧,营养素稀缺和高毒素。该过程称为肿瘤可塑性,要求他们重新编程其新陈代谢以满足他们的能量需求。在压力条件下,肿瘤细胞经常被迫在增殖和运动之间进行切换,这两者都需要很高的能量,改变了局部肿瘤生长和转移传播之间的平衡。Wistar之前的研究已经确定了线粒体在细胞侵袭和转移中的关键作用,线粒体被转移到肿瘤细胞的外围,为肿瘤细胞的运动提供能量。
在这项研究中,Altieri及其同事描述了一种新的由SNPH(一种最初只在神经元中发现的蛋白质)协调的转移抑制通路。他们发现了一种新的,更短的蛋白质变体,这种变体存在于许多正常和肿瘤组织并定位在线粒体中,作为“变阻器”,或分子开关,肿瘤细胞增殖和转移。
Altieri实验室在体外研究了短SNPH变异在前列腺癌和胶质母细胞瘤细胞中的功能。他们减少了SNPH的表达,并观察到能量缺陷,包括氧化应激,或自由基的积累,以及增殖的抑制。相反,强迫表达SNPH会抑制线粒体向细胞膜的重新定位,从而降低细胞的运动性。这些观察表明,SNPH促进肿瘤细胞增殖和局部肿瘤生长,但牺牲了侵袭和转移播散。在黑色素瘤小鼠模型的体内研究证实了SNPH在控制转移中的作用,并表明线粒体定位是SNPH功能所必需的。
此外,Altieri和同事观察到周围环境中的压力条件,例如低氧可用性,压抑的SNP表达。这种发现重申,关闭SNPH是肿瘤可塑性的关键机制,当局部环境不利时,允许肿瘤细胞停止增殖和兴致的细胞运动,以允许肿瘤细胞进行殖民替代位点。
“SNPH表达的减少是一个标志瘤进展,相关转移性疾病和糟糕的结果,”Jae Ho Seo博士说,他是Altieri实验室的副研究员和该研究的第一作者。“因为这种新的应激调节途径在癌细胞中被选择性地利用,而不是在正常组织中,它可能提供新的治疗机会,专门破坏转移的代谢需求。细胞”。
进一步探索















用户评论