研究人员发现端粒缩短与杜氏肌萎缩症功能障碍有关
佩雷尔曼医学院的研究人员在宾夕法尼亚大学已经发现对治疗肌肉萎缩症障碍表明新的可能性。今天在网上发表的一项研究干细胞的报道,研究人员发现干细胞在肌肉萎缩症患者的肌肉,在早期,失去再生能力新的肌肉,由于端粒缩短。
端粒是尾巴的染色体末端的DNA链保护染色体中细胞分裂。在许多细胞类型,端粒也作为生物倒计时钟,缩短每一次细胞分裂,直到他们减少长度触发细胞死亡或不活跃的,非区分状态称为衰老。专门的研究小组发现,端粒肌肉阀杆细胞异常短的十几岁的男孩杜氏肌肉营养不良症(DMD),以及年轻的老鼠用同样的遗传性疾病。端粒缩短的发现可能有助于解释为什么之前的研究已经发现在肌肉干细胞的功能缺陷肌肉萎缩症病人。
“我们发现,与DMD男孩,端粒短,肌肉干细胞可能是筋疲力尽,”说,该研究的资深作者,Foteini Mourkioti,博士,矫形外科助理教授和细胞和发育生物学,和肌肉骨骼再生联合项目在宾夕法尼亚大学再生医学研究所。“由于DMD,肌肉干细胞不断修复本身,这意味着端粒变得愈来愈短的速度越来越快,生活的更早。未来疗法防止端粒损失和保持肌肉干细胞可行可以减缓疾病的进展,提高病人的肌肉再生。”
肌肉在肌肉萎缩退化疾病,因为基因突变导致这些疾病离开肌肉纤维异常脆弱,所以他们被损坏甚至被普通的体育活动。原则上,肌肉干细胞可以再生失去肌肉,从而减缓甚至停止疾病的过程。但是一些科学家,包括Mourkioti,猜测,在肌肉萎缩症肌肉损伤的连续周期而repair-requiring几乎不间断地肌肉干细胞的细胞分裂cells-soon削弱肌肉干细胞的再生能力,通过缩短端粒和诱导早期死亡或衰老。
“试图找出的问题DMD肌肉干细胞发生的事情是,我们缺少足够的工具来测量在这些干细胞端粒长度,“Mourkioti说。
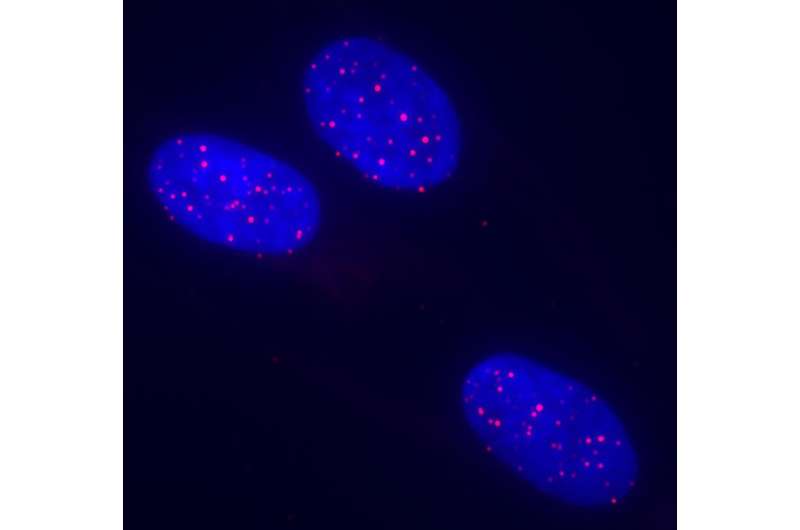
DMD患者,使他们的发现,Mourkioti和他的同事们开发了一种新的干细胞telomere-measuring方法,基于现有的技术称为荧光原位杂交(FISH)。端粒是由一个短的DNA序列构建块(TTAGGG)重复一遍又一遍,和新FISH-based方法(MuQ-FISH)使用荧光探针设计遵循专门的序列。更长的端粒积累更多的探测器和发出荧光明亮。这项技术可以用于显微镜和电子成像设备来测量在单个干细胞端粒的长度。
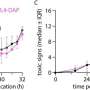
Mourkioti最初和她的团队使用他们的新技术表明,肌肉干细胞的端粒长度相同的健康实验室老鼠,老鼠是否年轻或年老。相反,科学家们发现,在年轻小鼠严重DMD-like障碍以及在几个十几岁的DMD患者,肌肉干细胞异常平均缩短端粒长度。其他non-stem DMD患者正常的肌肉细胞端粒长度。
肌肉干细胞的研究表明,端粒缩短专门渐进式肌肉弱化是一个因素,浪费在肌肉萎缩症患者。反过来,表明基因治疗和其他治疗方法已经被开发为肌肉营养不良可能是更有利的,如果管理之前,肌肉干细胞失去muscle-regenerating能力。研究结果还指出,未来治疗阻止端粒的缩短肌肉干细胞可以减缓甚至阻止疾病。Mourkioti和他的同事们现在打算雇佣他们的新方法来帮助他们找到治疗,着眼于早期干预,当这些干细胞仍能使新的肌肉。
“我们正在寻找细胞信号传导通路从而影响端粒长度肌肉干细胞原则上,这样我们可以开发药物来阻止这些途径和维护端粒长度,”Mourkioti说。“目前很少有人了解端粒缩短或维持的因素。”
大约有30个不同的肌肉萎缩症疾病,都由基因突变引起,影响肌肉细胞的完整性。DMD,最常见的是由x染色体上的基因突变,并影响一千五百分之一的男孩出生在美国。温和的肌肉萎缩症疾病通常导致终身残疾。更严重的,比如demand media,最终破坏所需的肌肉呼吸,和预期寿命减少到25岁左右。目前没有特效治疗方法,可以阻止这些疾病的进展。
进一步探索